在疾病发生过程中,人体共生菌发生了系统性的变化,起到了正向或负向作用,因此可以把共生菌看作人体活动的一个重要外部器官。
癌细胞通过释放特定信号,给免疫系统“踩刹车”,抑制免疫系统的识别和杀伤。这类免疫系统的刹车被称为“免疫检查点”。PD-1/PD-L1就是一对免疫检查点,癌细胞可以通过表达PD-L1,结合T细胞表面的PD-1,抑制T细胞的杀伤功能。基于这一原理,针对免疫检查点开发药物,阻止癌细胞对免疫功能踩刹车,从而重新唤起免疫系统的机能,杀伤癌细胞。
2015年,在小鼠模型中证明,共生双歧杆菌的存在可以促进肿瘤免疫药物的作用,操纵微生物群可能会调节癌症免疫治疗[1]。2018年,发现在黑色素瘤患者中,人体对癌症免疫药物抗PD -1的反应程度也和共生菌群的特征有关[2]。
2023年5月,哈佛大学医学院的科学家团队在《Nature》上发表题为“Targeting PD-L2–RGMb overcomes microbiome-related immunotherapy resistance”的研究论文,发现了另一个“免疫检查点”——RGMb,此次研究进一步发现,PD-L2与RGMb的相互作用取决于肠道菌群的组成,该发现为人类癌症免疫治疗提供新的方向[3]。

测序方法
16S rRNA v4区测序追踪小鼠肠道菌群的变化
实验主要结论
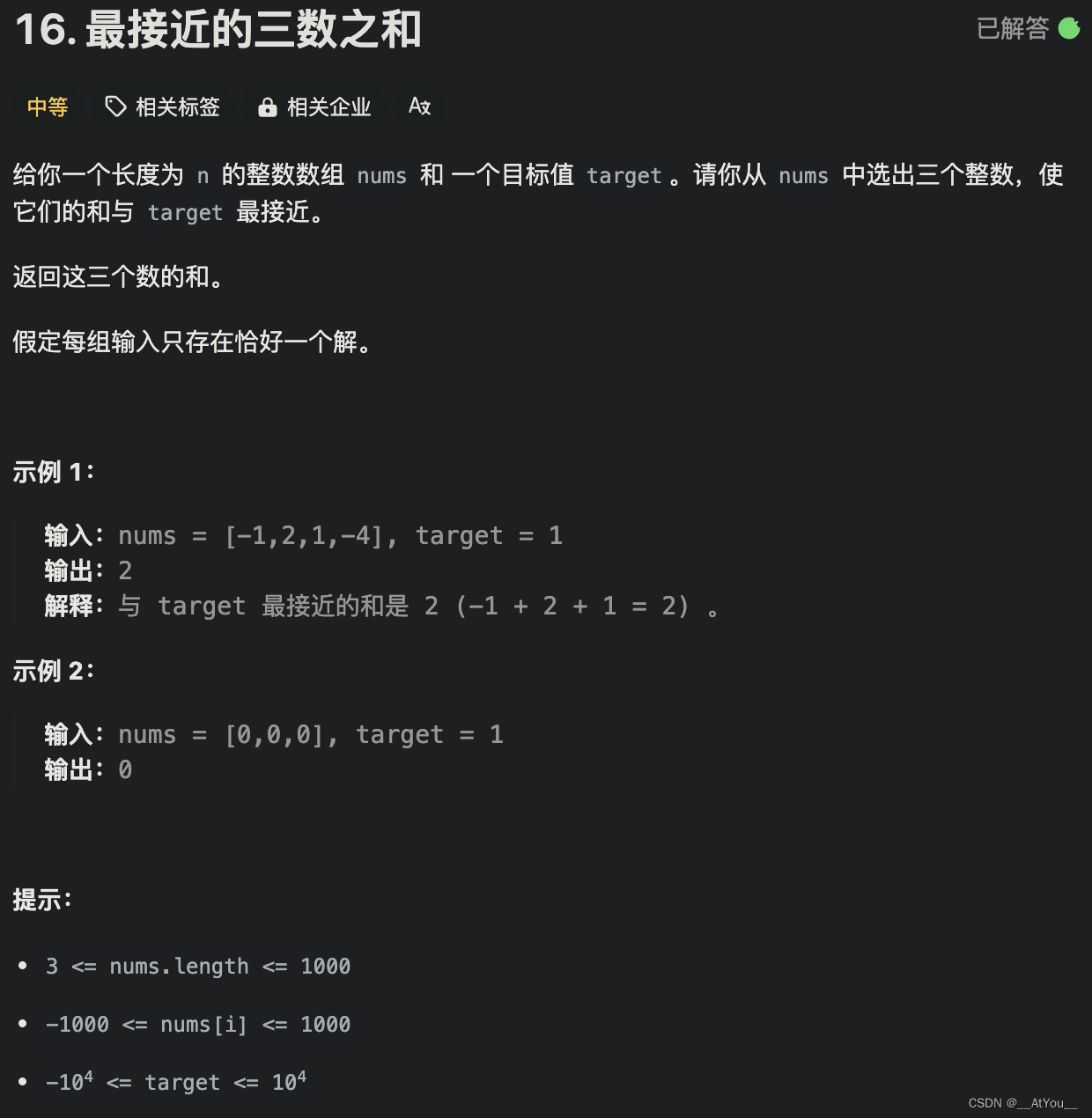
1. 研究者们建立了小鼠肿瘤模型,其中抗肿瘤反应依赖于肠道细菌。无特定病原体(SPF)鼠和无菌(GF)鼠皮下荷瘤(MC38),腹腔注射免疫检查点抑制剂抗体,SPF荷瘤鼠可响应抗PD-L1治疗,而GF荷瘤鼠既不响应抗PD-L1也不响应抗PD-1,但是GF荷瘤鼠补充健康人菌群(HMB)或健康鼠菌群(MMB)后,恢复响应抗PD-L1。结果表明微生物群促进抗肿瘤反应阻断,抑制PD-L1的表达。
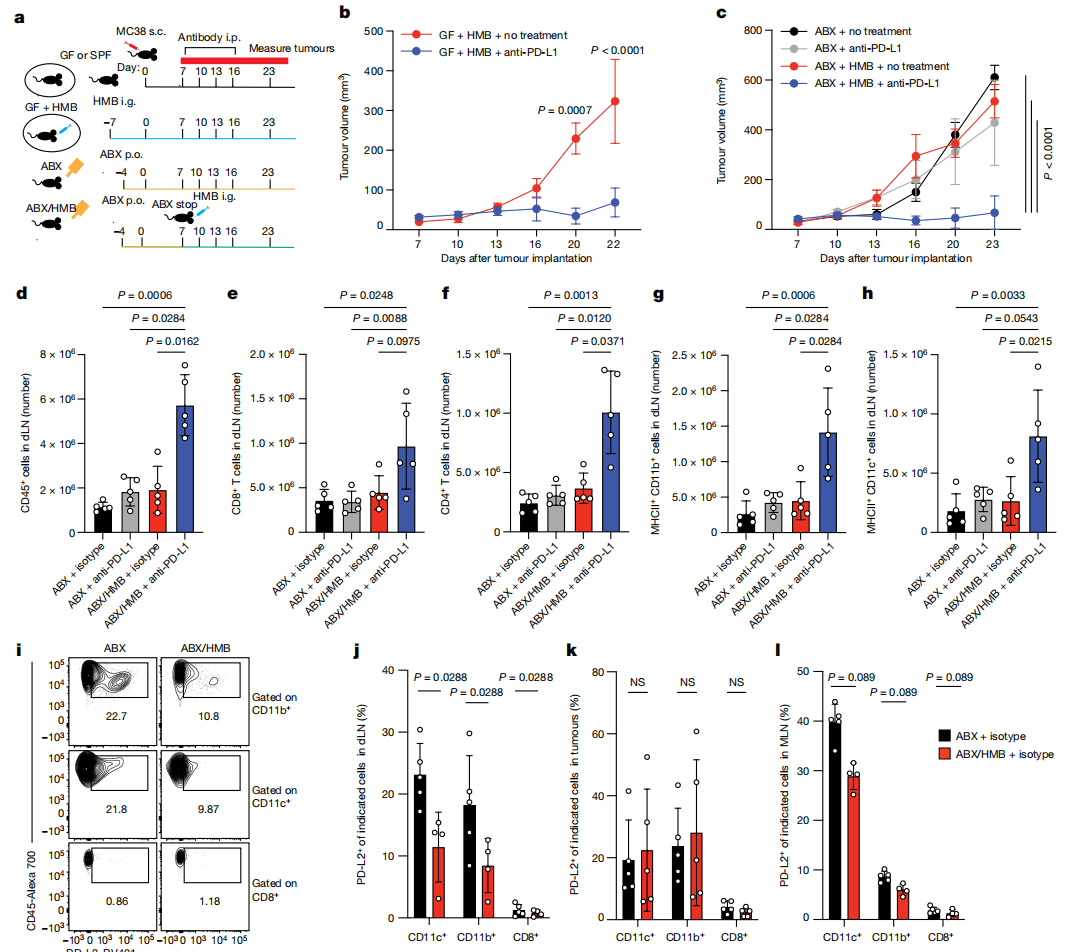
2. 使用不同的抗生素处理小鼠,再用16S RNA测序和单细菌培养的方法追踪小鼠肠道菌群的变化,发现一种特殊的细菌类型——粪芽孢杆菌(Coprobacillus cateniformis)。这类细菌被消灭,小鼠就失去了对癌症免疫药物的响应;而只要给无菌小鼠移植这么一种细菌,癌症免疫药物就又可以成功杀伤肿瘤了,因此粪芽孢杆菌是癌症免疫药物起效的关键。
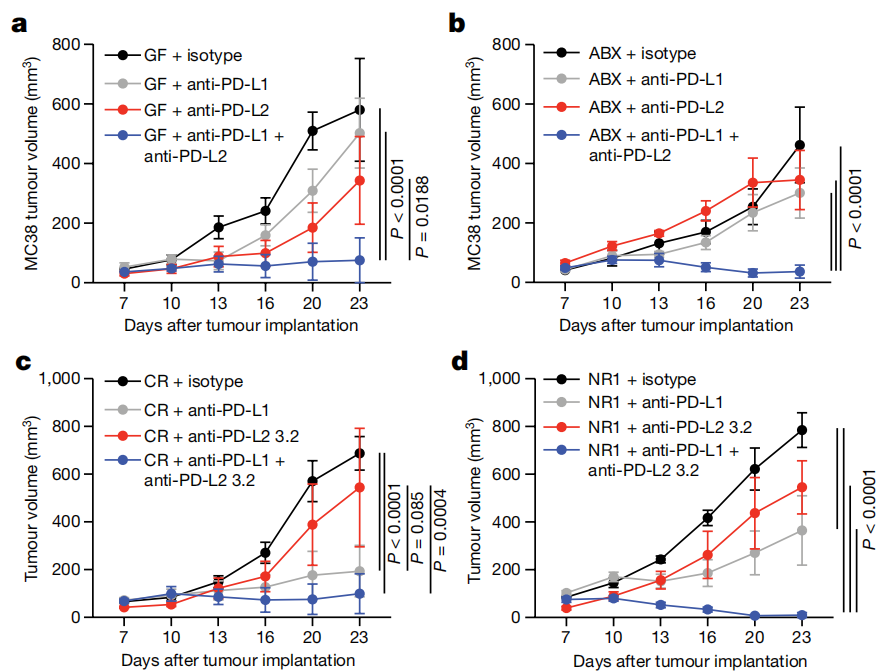
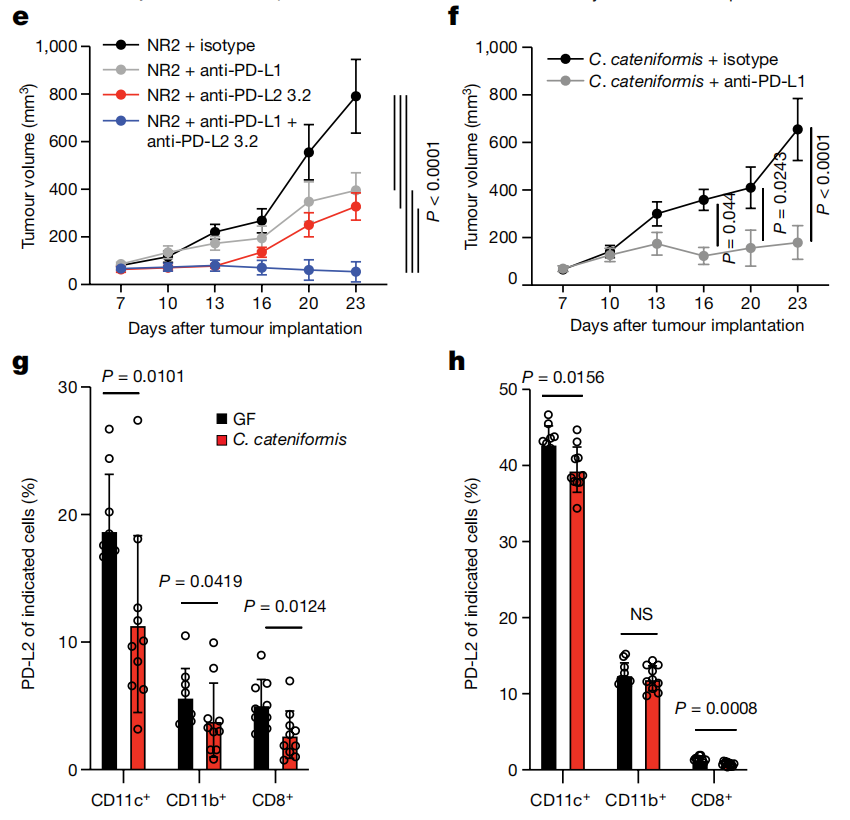
3. 粪芽孢杆菌可以直接抑制树突状细胞中PD-L2的表达,刺激树突状细胞的活动,增强癌症免疫药物的效果。在肠道菌群和癌症免疫治疗的关系中,树突状细胞和PD-L2起到了枢纽作用,而肠道细菌(如粪芽孢杆菌)可以直接抑制树突状细胞内部的PD-L2,刺激树突状细胞的功能,让癌症免疫药物得以起效。
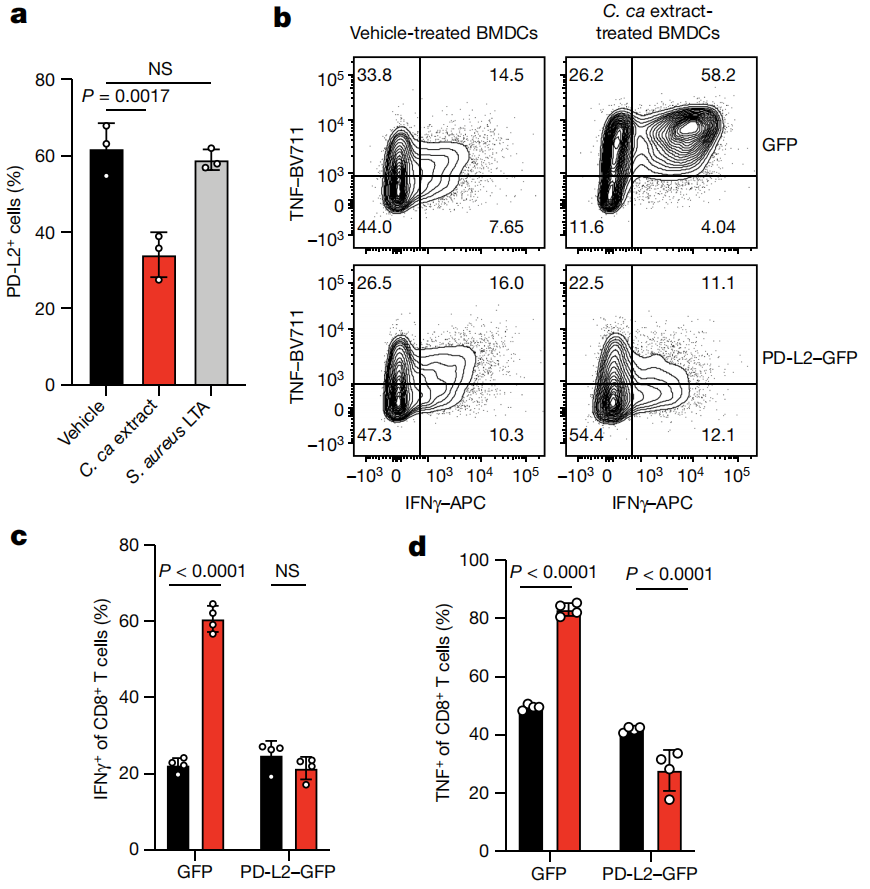
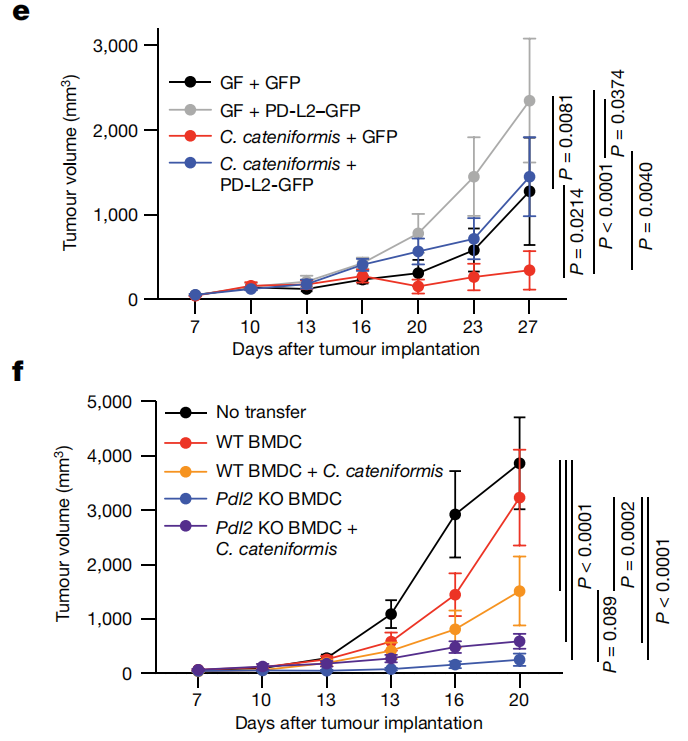
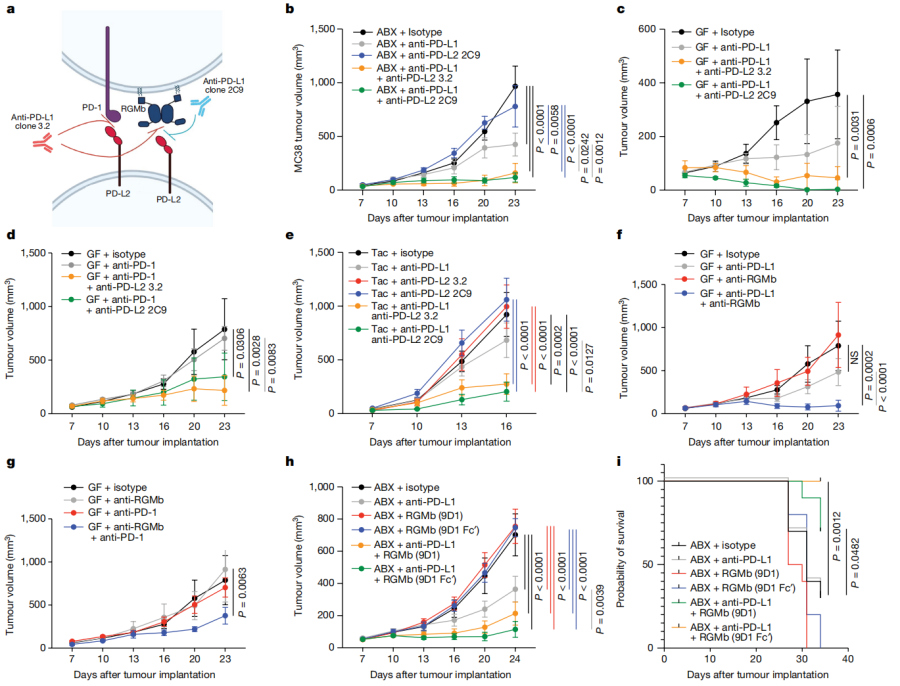
4. 研究发现,除了PD-1,PD-L2还有另外一个作用目标——RGMb。单纯阻断PD-L2和RGMb的结合,就足以重新激活无菌小鼠的免疫系统,让肿瘤免疫药物起作用;而敲除免疫细胞中的RGMb,或直接设计抗体药物干扰RGMb的功能,也能起到类似的效果。
针对医口客户,凌恩生物推出特色医口扩增子项目,报告内容贴近临床需求,更多分析内容请关注凌恩生物公众号。

参考文献
[1]Commensal Bifidobacterium promotes antitumor immunity and facilitates anti–PD-L1 efficacy. Science,2015.
[2]Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science,2018.
[3]Targeting PD-L2–RGMb overcomes microbiome-related immunotherapy resistance.Nature,2023.