大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
m5C是已知的RNA修饰之一,但其在mRNA中的发育动态、功能和进化仍然知之甚少。最初报道m5C在mRNA中普遍存在,但后来认识到许多最初被鉴定的位点可能假阳性。准确和系统地检测转录组范围mRNA m5C水平一直具有挑战性,缺乏对m5C修饰丰度和分布一致性观点。为了克服这一挑战,2019年研究人员基于富集mRNA的RNA亚硫酸盐测序(BS-seq)可以稳健的鉴定和定量分析mRNA m5C位点。RNA-BS通常在成年哺乳动物组织中只鉴定出几百个mRNA m5C位点,这些有限的位点分类为两种类型:Type I m5C位点和Type II m5C位点。Type I m5C位点包含下游富含G的三联体motif,位于发夹结构的5'端,由NSUN2甲基化;Type II m5C位点,包含下游UCCA motif,位于发夹结构的环中,由NSUN6甲基化。
为理解mRNA m5C的分布、功能和进化,中山大学张锐、徐艳文、周灿权团队和浙江大学戈万忠团队利用RNA-BS测序技术对6个动物物种样本进行分析,以构建不同发育阶段的mRNA m5C的定量图谱。分析结果表明mRNA m5C主要存在于母源mRNA。进一步使用细胞模型和动物模型来研究母源mRNA广泛甲基化背后的机制以及m5C在早期胚胎发育中的生物学重要性。最后利用比较表观转录组方法揭示两个主要的m5C调控创新步骤和单m5C位点的快速进化。相关研究成果以“Developmental mRNA m5C landscape and regulatory innovations of massive m5C modification of maternal mRNAs in animals”为题在Nature子刊《自然通讯》(Nature Communications)上发表。

标题:Developmental mRNA m5C landscape and regulatory innovations of massive m5C modification of maternal mRNAs in animals
中文题目:动物中发育mRNA m5C图谱和母源mRNA大规模m5C修饰的调控创新
发表期刊:Nature Communications
影响因子:IF 14.7 / 1区
本研究通过RNA-BS生成了果蝇、斑马鱼、非洲爪蟾、热带爪蟾、小鼠、人类这六个物种(包括脊椎动物和无脊椎动物)共计82个样本在不同发育阶段的定量mRNA m5C图谱。分析结果表明发现母源mRNA的巨大甲基化由NSUN2和NSUN6介导,且这种现象趋同且意外。以果蝇作为模型,揭示了缺乏母源mRNA m5C的胚胎经历了细胞周期延迟,并未能及时启动母源-合子转换(maternal-to-zygotic transition),表明了母源mRNA m5C的功能重要性。从无脊椎动物到人类的谱系,观察到两波m5C调控创新:更高等动物在mRNA的5'端获得由NSUN2介导的顺式m5C位点,同时伴随着更具结构化的5'UTR区域的出现;人类获得个由NSUN6介导的横向m5C位点,这些位点在调控有丝分裂细胞周期的基因中富集。本研究表明了早期胚胎发育机制的存在及其调控创新,并为阐明mRNA m5C在生物学和疾病中的作用提供了关键资源。
研究方法:
样本收集:从6个不同物种(包括人类、小鼠、斑马鱼、果蝇等)收集了多个发育阶段的样本。
RNA亚硫酸盐测序(RNA-BS-seq):用于富集mRNA并定量m5C位点。
基因编辑:使用CRISPR/Cas9系统在果蝇中生成NSUN2基因突变体。
RNA-seq:分析野生型和NSUN2敲除果蝇胚胎的转录组。
结果图形:
(1)在脊椎动物和无脊椎动物物种中,母源mRNA高甲基化
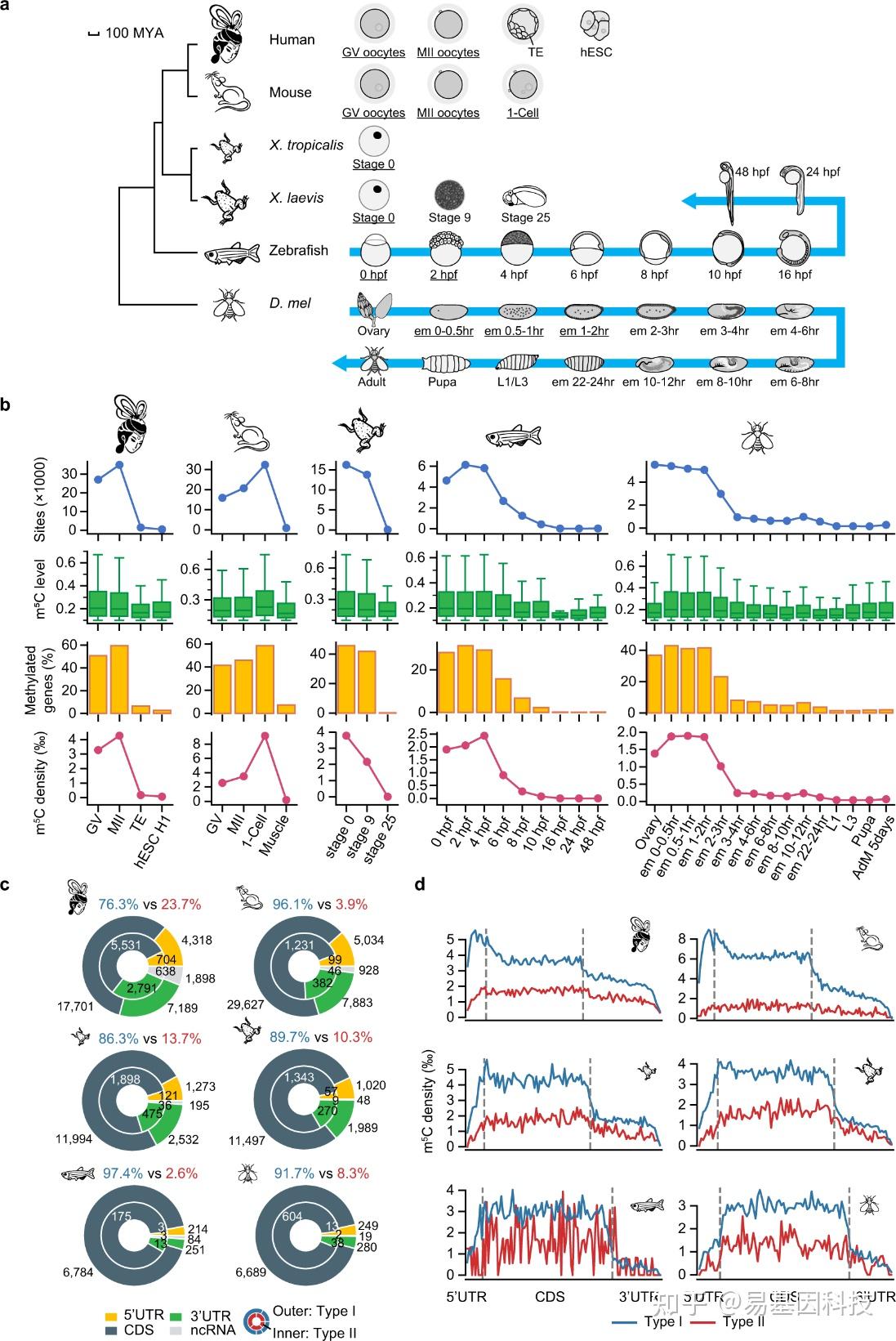
图1:在脊椎动物和无脊椎动物中,母源mRNAs通过NSUN2和NSUN6高甲基化。
- 系统发育树(左)和本研究中采样的物种发育阶段(右)。
- 本研究分析的样本中m5C位点的数量和甲基化水平,带有m5C位点的转录基因的百分比,以及m5C位点的密度。密度定义为每千个C(至少被20次reads)的m5C位点数量。选择了在成年组织中具有最高m5C水平的小鼠肌肉样本29来代表合子mRNA m5C模式。
- 每个物种中母源m5C位点的基因位置。标明了m5C位点的数量和Type I和Type II位点的百分比。
- 不同物种中母源m5C位点的转录本分布。
(2)在非人类物种中,母源mRNA的m5C修饰主要由NSUN2沉积
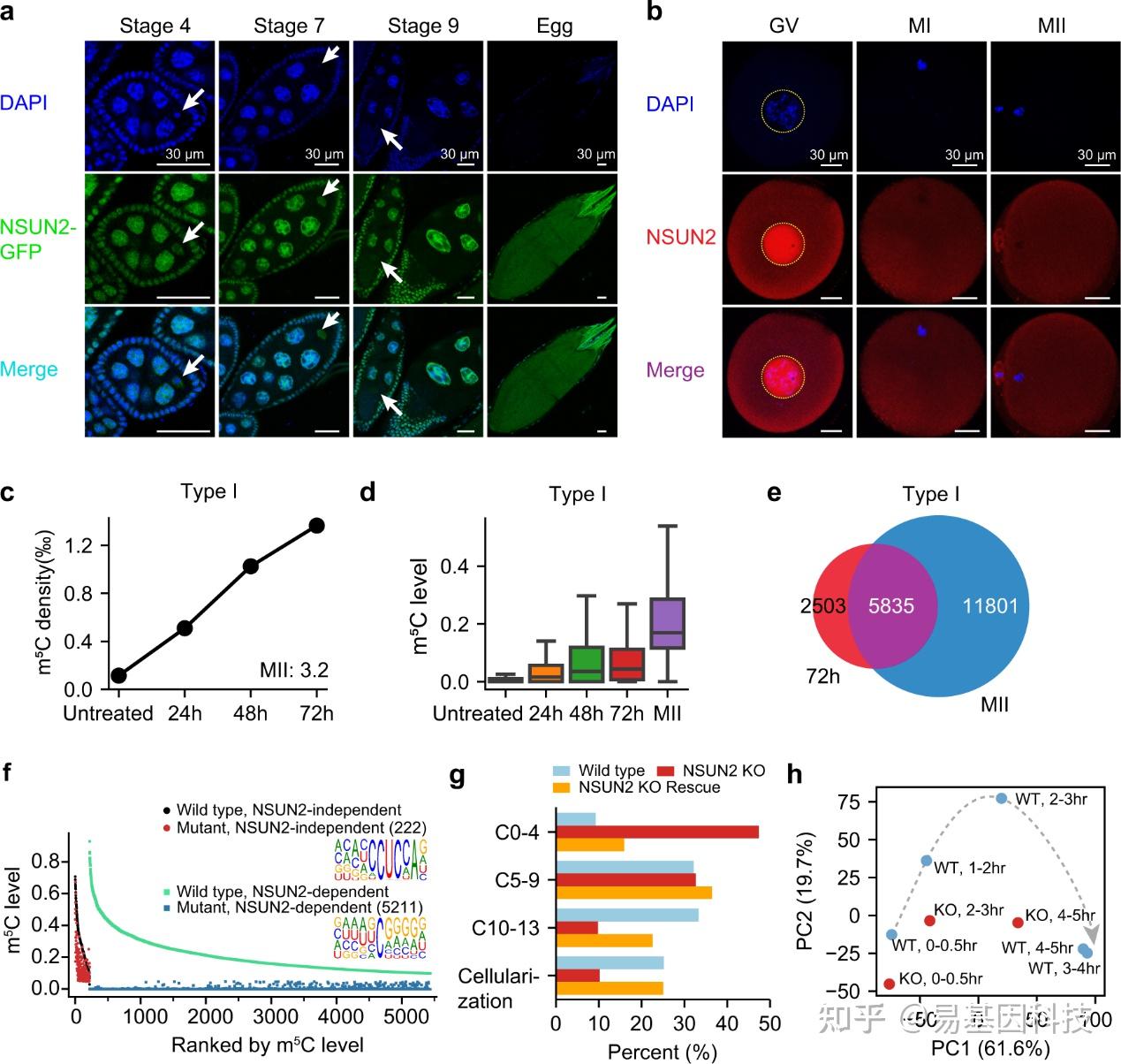
图2:卵母细胞中mRNA m5C的沉积以及NSUN2在早期胚胎发生中的体内功能。
- 在不同阶段的果蝇卵巢表达GFP-NSUN2融合蛋白的代表性图像,该融合蛋白在其天然启动子调控下表达。
- 用抗NSUN2抗体染色的人类GV/MI/MII卵母细胞的代表性图像。11个GV,14个MI,和14个MII卵母细胞被染色,所有检查的卵母细胞中NSUN2的定位一致。
c-d. 经nocodazole处理0, 24, 48, 和72小时的HeLa细胞中Type I m5C位点的密度(c)和水平(d)。
e. 经nocodazole处理72小时的HeLa细胞和MII卵母细胞之间Type I mRNA m5C位点的重叠。
f. 野生型果蝇和NSUN2敲除果蝇卵巢中m5C甲基化水平的比较。显示Type I和Type II m5C位点。
g. 0-2小时胚胎在不同胚胎发育阶段的百分比定量。
h. 前两个主成分分析(PCA),共同解释了转录组数据中82.6%的变异。
(3)在高等动物中,顺式调控创新介导5'端Type I位点增加
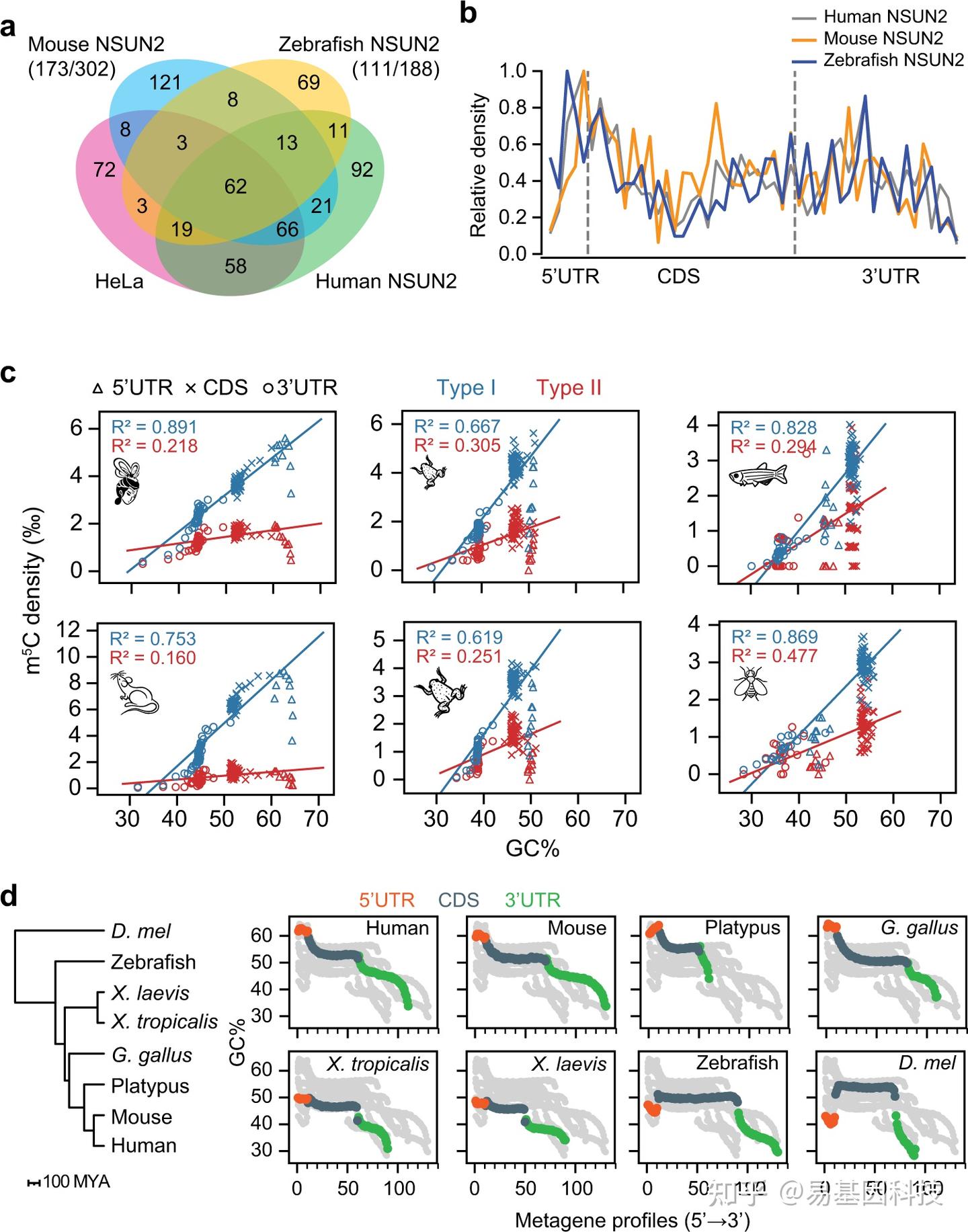
图3:顺式调控创新导致高等动物中5'端Type I位点增加。
- 维恩图显示了在野生型HeLa细胞和单独表达人类、小鼠和斑马鱼NSUN2的NSUN2敲除HeLa细胞中鉴定的Type I位点的重叠。
- 在单独表达人类、小鼠和斑马鱼NSUN2的NSUN2敲除HeLa细胞中Type I m5C位点的分布。
- 母源m5C密度与转录组GC含量之间的关系。
- 不同物种的GC含量的宏基因组分析。通过对更具代表性的脊椎动物物种分析,发现在鸟类和哺乳动物的共同祖先中获得了5'端高GC含量。
(4)跨式调控创新导致数千个人特异性Type II位点增加
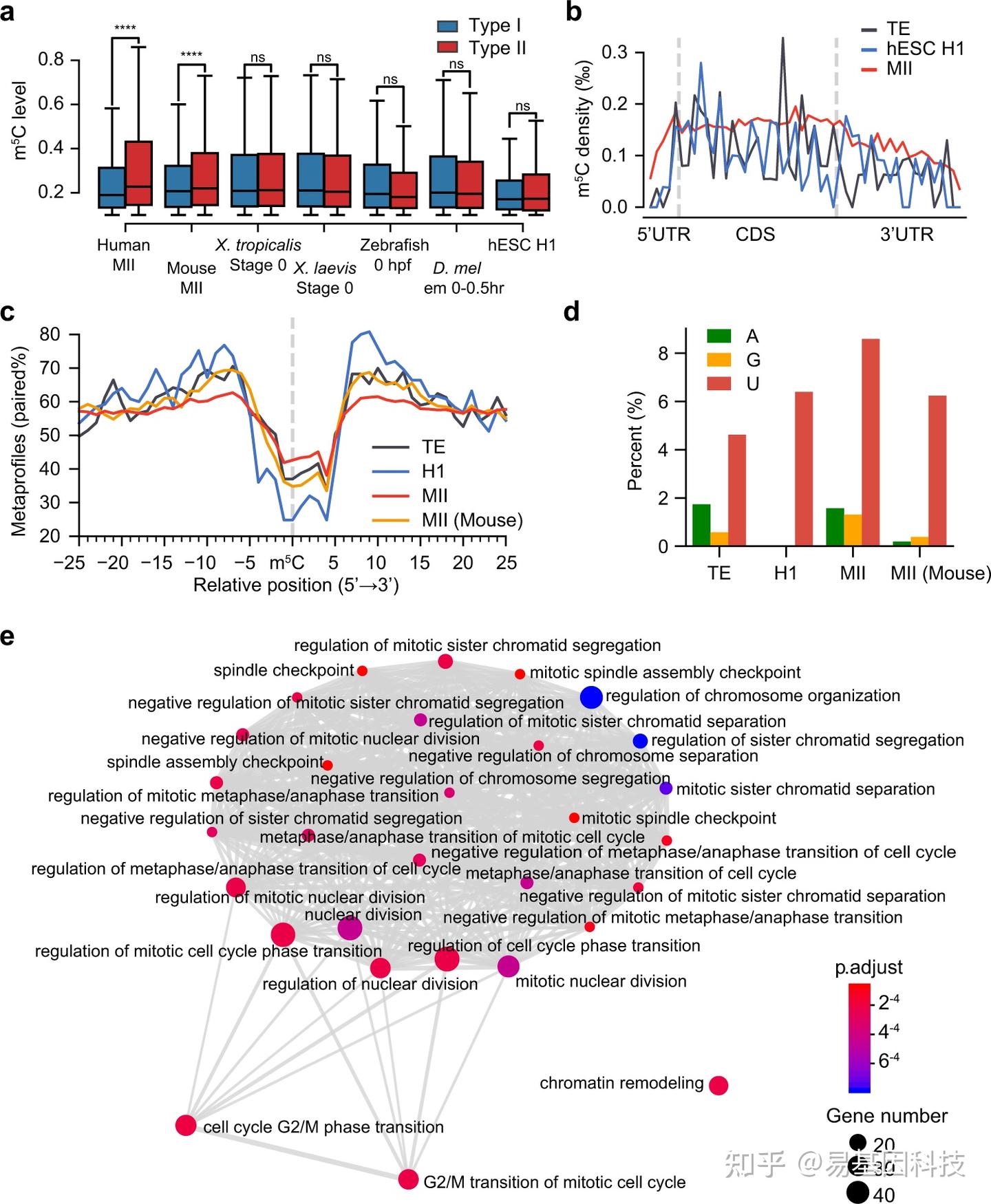
图4:顺式调控创新导致数千个人特异性Type II位点增加。
- 比较了代表不同物种母源mRNA甲基化状态的选定样本以及代表人类合子mRNA甲基化状态的hESC H1中Type I和Type II位点的水平。
- 人类MII卵母细胞、hESC H1和人类TE中Type II m5C位点的分布。
- 人类MII卵母细胞、hESC H1、人类TE和小鼠MII卵母细胞中Type II m5C位点及其相邻区域的二级结构metaprofiles。
- 人MII卵母细胞、hESC H1、人TE和小鼠MII卵母细胞中Type II位点核心motif位点+3碱基组成。
- 人类MII卵母细胞中仅由NSUN6调控的基因的富集图。
(5)m5C位点的快速进化。
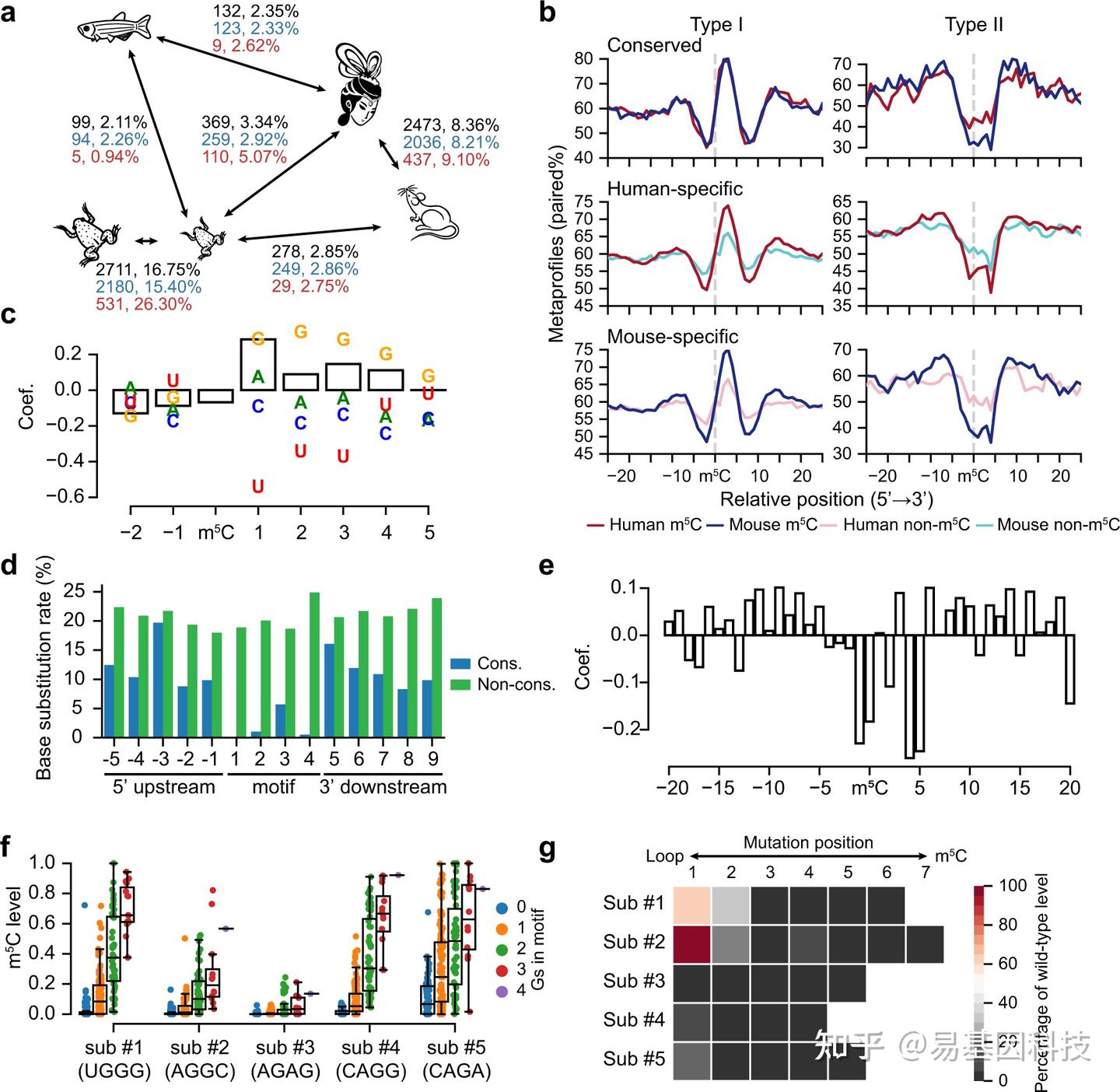
图5:mRNA m5C的序列和结构依赖性进化。
- 脊椎动物物种间保守m5C位点的数量和百分比的成对比较。线条的长度与物种间的分化时间成比例。分别展示了所有m5C位点(黑色)、Type I m5C位点(蓝色)和Type II m5C位点(红色)的数量和百分比。使用的样本:人类和小鼠,MII期卵母细胞;青蛙,0期;斑马鱼,0小时受精后(hpf);果蝇,0-0.5小时胚胎。保守的甲基化位点,指在一个物种中水平≥10%,在另一个物种中水平>5%的m5C位点。只考虑在两个物种中至少被十次reads覆盖的保守C。
- 人类和小鼠之间保守和非保守Type I和Type II m5C位点的二级结构的metaprofiles。保守的,指在两个物种中都甲基化的m5C位点。人类特异的或小鼠特异的,指在两个物种的DNA水平上都是C,但只在人类或小鼠中甲基化的m5C位点。使用的样本:人类和小鼠MII期卵母细胞。
- 人类和小鼠之间Type I位点获得或丢失的序列和结构因素的GLM系数。
- 人类和小鼠之间保守和非保守Type II位点的基序和相邻区域的碱基替换率。
- 人类和小鼠之间Type II位点获得或丧失的结构特征的GLM系数。
- Type I motif中G的数量与五个Type I底物的m5C水平之间的关系。
- 5个Type I底物的茎突变与它们的m5C水平之间的关系。
关于易基因RNA m5C甲基化测序(RNA-BS)技术
m5C是RNA百余种修饰中研究较多的一种。m5C存在于tRNA上时,可以对翻译进行调节;存在于rRNA上时,可以对核糖体的生物合成进行质控;存在于mRNA上时,则可以影响mRNA的结构、稳定性及翻译过程。
易基因提供适用于不同科研需求的m5C甲基化测序技术:
- 常规mRNA m5C甲基化测序(RNA-BS):
mRNA分离后首先通过亚硫酸盐处理,非甲基化的C转变为U,m5C修饰的碱基保持不变,结合高通量测序,可以对RNA上的每一个C碱基修饰进行定位与定量。 - 常规mRNA +lncRNA m5C甲基化测序(全转录组RNA-BS):
易基因科技建立的升级版m5C RNA甲基化测序服务,去除人rRNA后,剩余RNA经重亚硫酸盐处理后,结合高通量NGS策略,可在全转录组范围内单碱基分辨率地检测基因m5C甲基化修饰分布。
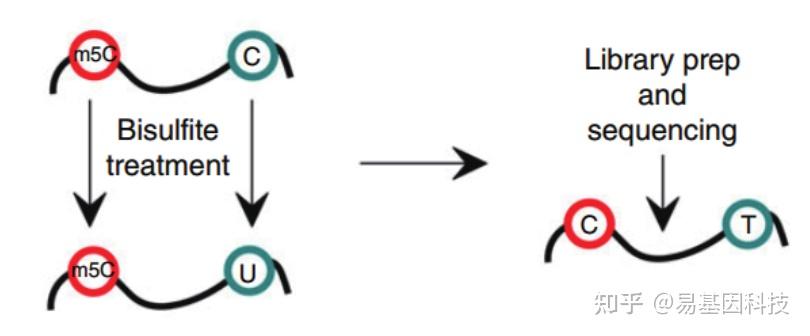
技术优势:
- 高深度:超高深度重亚硫酸盐处理,检测准确性极高;
- 高通量:结合高通量NGS,全转录组范围内检测;
- 单碱基:单碱基分辨率,快速检测和分析RNA中的m5C。
- 高准确:精确的检测mRNA等每一个C碱基的的修饰水平。
研究方向:
- 与m6A甲基化类似,m5C甲基化已被证明与肿瘤、神经系统紊乱、代谢性疾病、病毒感染以及个体发育等密切相关。
- 此外,RNA甲基化(m5C)与人类疾病密切相关,其功能涉及调控干细胞应激、细胞毒性应激、mRNA出核和植物细胞发育及基因表达等方面。
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C、RIP)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Liu J, Huang T, Chen W, Ding C, Zhao T, Zhao X, Cai B, Zhang Y, Li S, Zhang L, Xue M, He X, Ge W, Zhou C, Xu Y, Zhang R. Developmental mRNA m5C landscape and regulatory innovations of massive m5C modification of maternal mRNAs in animals. Nat Commun. 2022 May 5;13(1):2484. pii: 10.1038/s41467-022-30210-0. doi: 10.1038/s41467-022-30210-0. PubMed PMID: 35513466.
相关阅读:
Nature子刊:多组学测序分析揭示m5C甲基化上调E2F1表达以促进卵巢癌肿瘤进展
项目文章 | Adv Sci:NSUN2介导m5C修饰代谢重编程促进肿瘤进展 揭示治疗新选择
项目文章 | NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
技术推介|RNA m5C甲基化测序(RNA-BS)