大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
结直肠癌(colorectal cancer,CRC)是全球范围内致死率极高的癌症之一,尤其是晚期患者。尽管手术切除是CRC的主要治疗手段,但肿瘤转移仍是影响患者长期生存的关键难题,而化疗对于提高生存率的效果有限。糖皮质激素(Glucocorticoids,GCs)通常用于缓解化疗引起的严重副作用,然而,有证据显示GCs可能削弱化疗药物的效果,并可能加速疾病进展。目前,关于GCs如何影响化疗效果和促进肿瘤发展的分子机制尚不完全清楚,而揭示这些机制对于深化我们对癌症治疗中GCs作用的理解及可能的改进至关重要。
先前的研究发现糖皮质激素受体(glucocorticoid receptor,GR)与胸腺嘧啶-DNA糖基化酶(TETs)之间存在相互作用,并提出了GR与TETs酶相互作用的假设。该发现可以为理解GCs在癌症治疗中的作用提供新的视角,并可能为改善癌症患者的GC治疗策略提供科学依据。
近日,中国农业科学院深圳农业基因组研究所宋琰未和任书强博士为共同第一作者,丹麦哥本哈根大学副教授/中国科学院HIM-BGI 组学中心研究员高飞为通讯作者,在《International Journal Of Cancer》杂志发表题为“Glucocorticoid promotes metastasis of colorectal cancer via co-regulation of glucocorticoid receptor and TET2”的研究论文,利用共免疫沉淀(Co-IP)、染色质免疫沉淀测序(ChIP-seq)、Western blot、药物再定位等实验揭示了GCs通过与GR和TET2共调控促进CRC转移中的分子机制,并探索可能的治疗策略。易基因科技参与本研究提供ChIP-seq等技术支持。

标题:Glucocorticoid promotes metastasis of colorectal cancer via co-regulation of glucocorticoid receptor and TET2
期刊:International Journal Of Cancer
影响因子:IF 6.4 / 1区
技术平台:Co-IP、ChIP-seq、RNA-seq等
研究对HEK293T细胞使用GR和TET家族蛋白(TET1、TET2、TET3)抗体进行共免疫沉淀(Co-IP)和染色质免疫沉淀测序(ChIP-seq);通过Connectivity Map数据库,利用HEK293和HCT116细胞系中GR和TET2的共有靶基因以及CRC差异表达基因(DEGs)进行药物再定位;在表达GR水平不同的CRC细胞系(即HCT116和HT29细胞系)中进行细胞迁移和侵袭实验,地塞米松(Dex)处理导致两个表达GR水平不同的CRC细胞系的细胞迁移率出现显著差异。Co-IP和ChIP-seq分析验证了HEK293T细胞中GR和TET家族蛋白之间的互作。所选化合物Belinostat成功验证了其抗GC诱导的CRC细胞侵袭潜力。对Belinostat处理的HCT116细胞转录组分析揭示了与癌症转移相关的靶基因下调。
本研究研究为理解GC诱导转移的分子机制提供了宝贵的见解,引入了可能作为GC治疗潜在辅助疗法的新定位化合物。此外,本研究为探索CRC治疗的新药候选物指明了方向。
研究亮点:
对结直肠癌(CRC)细胞中糖皮质激素诱导转移效应的机制研究表明,在糖皮质激素(GC)暴露后,不同糖皮质激素受体(GR)表达水平的CRC细胞迁移率显著变化。GR与TETs酶互作将糖皮质激素信号和表观遗传调控相关联。用belinostat共靶向GR和TET导致与转移相关基因下调,为糖皮质激素与癌症之间的关系提供新见解。
研究摘要
研究方法
- 细胞培养和转染:对HT29和HCT116细胞系进行实验,通过脂质体介导的转染方法过表达TET3和GR。
- Western blot分析:检测蛋白表达水平。
- 细胞迁移和侵袭实验:评估不同GR表达水平的CRC细胞系对地塞米松(Dex)治疗的迁移反应。
- 共免疫沉淀(Co-IP):研究GR与TET家族蛋白之间的互作。
- RNA-seq和ChIP-seq测序:分析GR和TET蛋白的共有靶基因。
- 药物再定位:利用Connectivity Map数据库,基于GR和TET2共有靶基因进行药物再定位分析。
结果图形
(1)GR表达作为糖皮质激素诱导细胞迁移的中介及其对结直肠癌患者生存的影响;与GC促进CRC细胞迁移相关的GR相关基因程序。
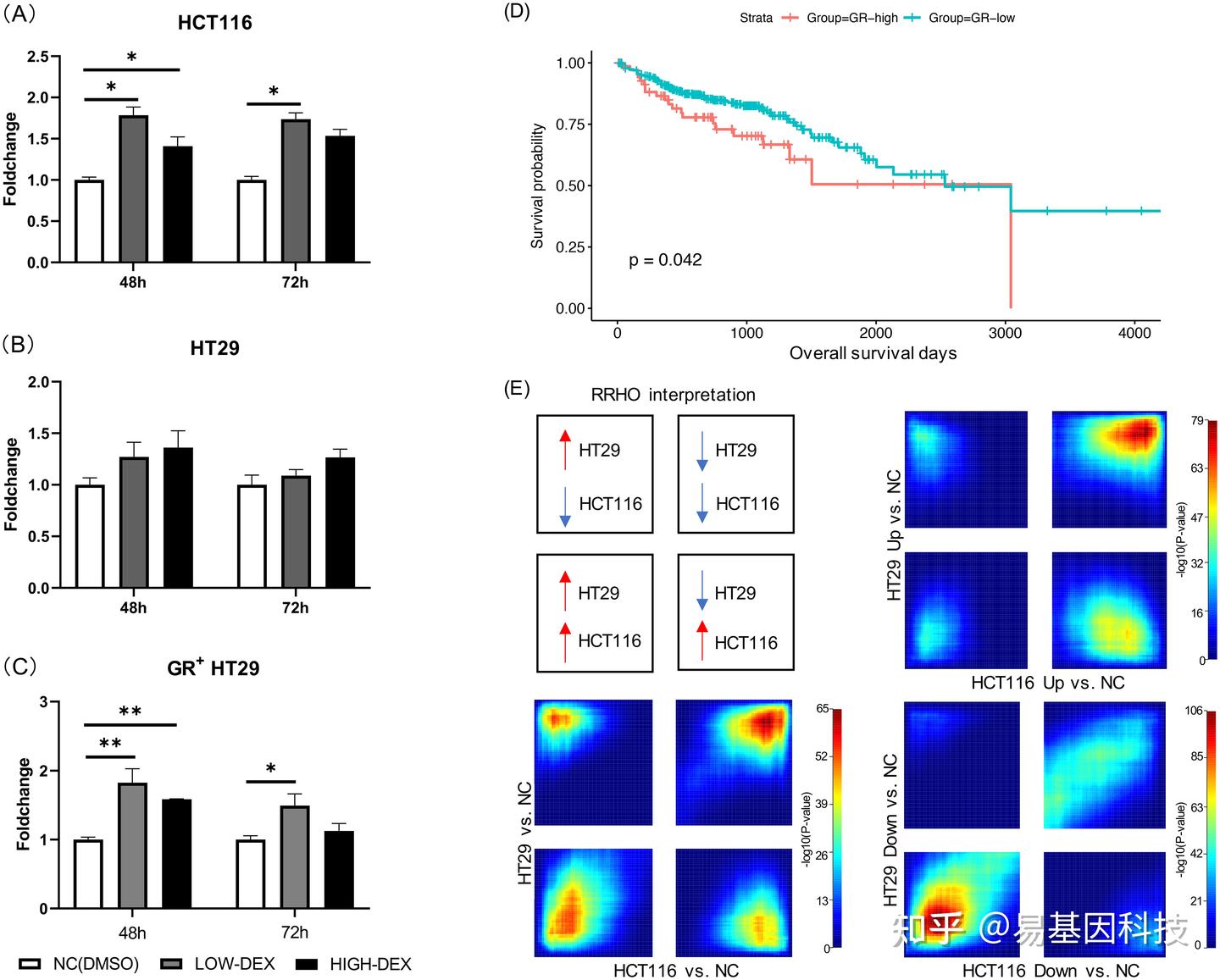
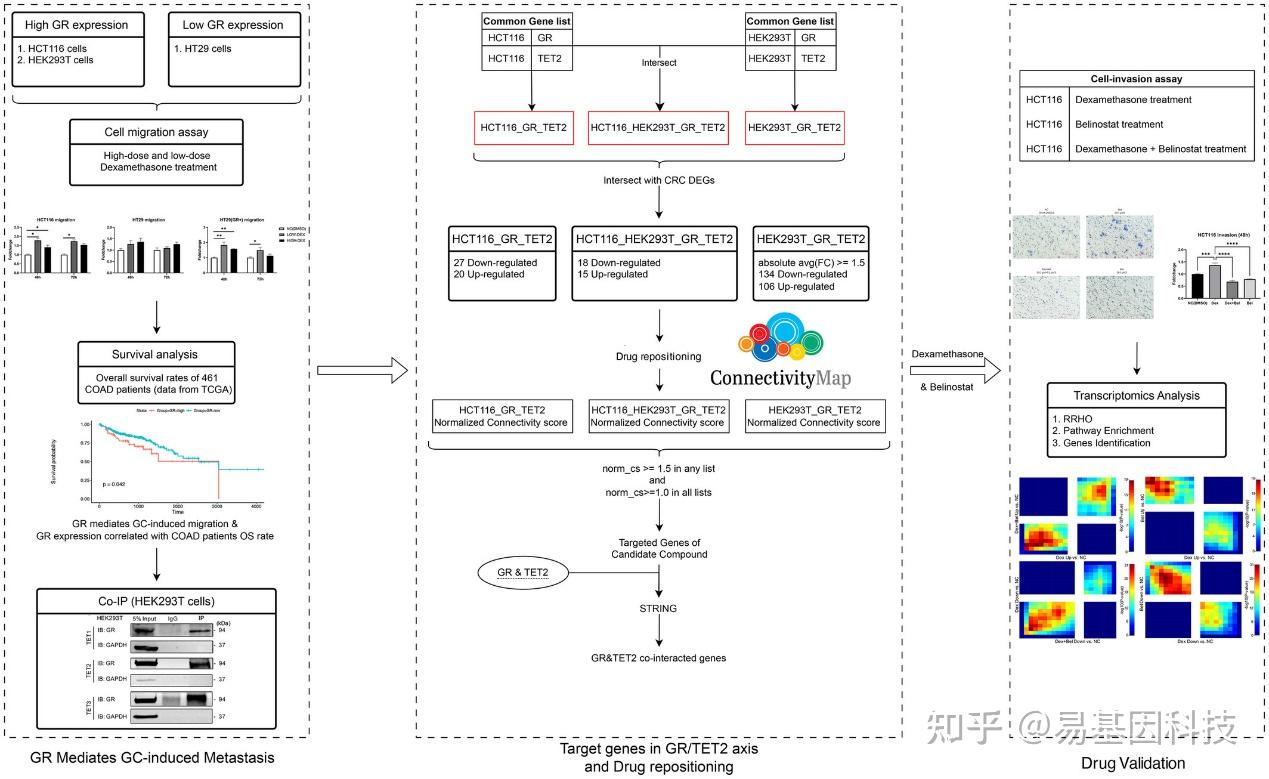
图1:糖皮质激素(GC)处理下的细胞迁移。
(A-C) HCT116(A)、HT29(B)和过表达GR的HT29(GR+ HT29)(C)分别用不同剂量的地塞米松(Dex)处理(对照组:0 nM;低剂量:100 nM;高剂量:1 μM)48小时和72小时。迁移的细胞通过乙酸依赖的结晶紫洗脱和590nm检测吸光度进行定量分析。
(D) TCGA数据集中461位COAD患者的整体Kaplan-Meier生存曲线,比较GR低表达组与GR高表达组。GR低表达:GR基因表达<1200;GR高表达:GR基因表达≥1200。
(E) HCT116细胞Dex处理与对照组以及HT29细胞Dex处理与对照组之间的Rank-rank超几何重叠(RRHO)分析。
(2)GR与TET家族蛋白的互作及其共靶基因鉴定
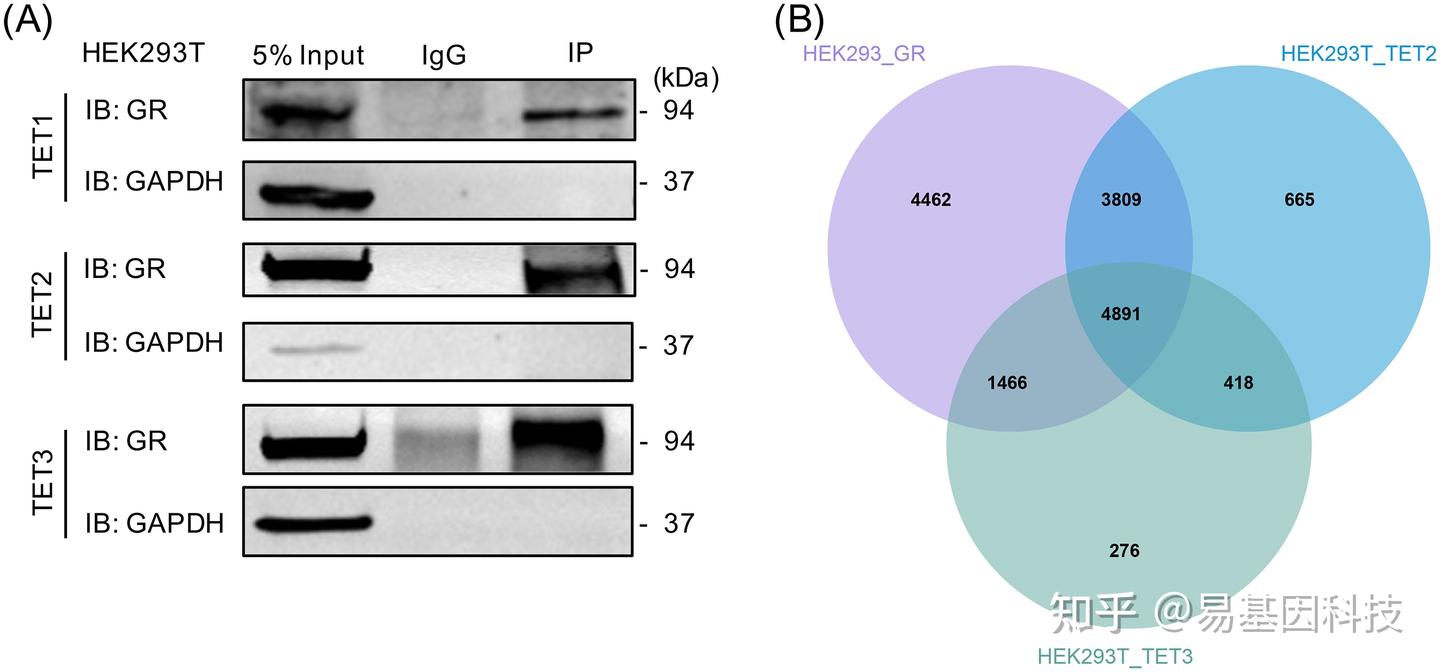
图2:鉴定GR与TET蛋白的蛋白互作。
(A) GR与TET1、TET2和TET3蛋白的蛋白互作。从转染了TET1-FLAG、TET2-FLAG和TET3-FLAG的HEK293T细胞制备的全细胞裂解液,并使用抗FLAG抗体进行免疫沉淀,随后使用靶向指定蛋白的抗体进行免疫印迹。
(B) Venn图显示了GR在HEK293细胞中的目标重叠基因,以及TET2和TET3在HEK293T细胞中的目标重叠基因。
(3)基于核心共有靶基因GR和TET2蛋白的CRC药物再定位。
图3:基于GR、TET2和CRC差异表达基因(DEGs)的共有靶基因列表的表观药物鉴定。
(A) 热图显示不同基因列表中选定的潜在化合物(行)。
(B) 化合物靶向基因、GR和TET2之间的蛋白互作。
(4)在HCT116细胞中验证再定位药物belinostat在GC诱导转移中的作用。
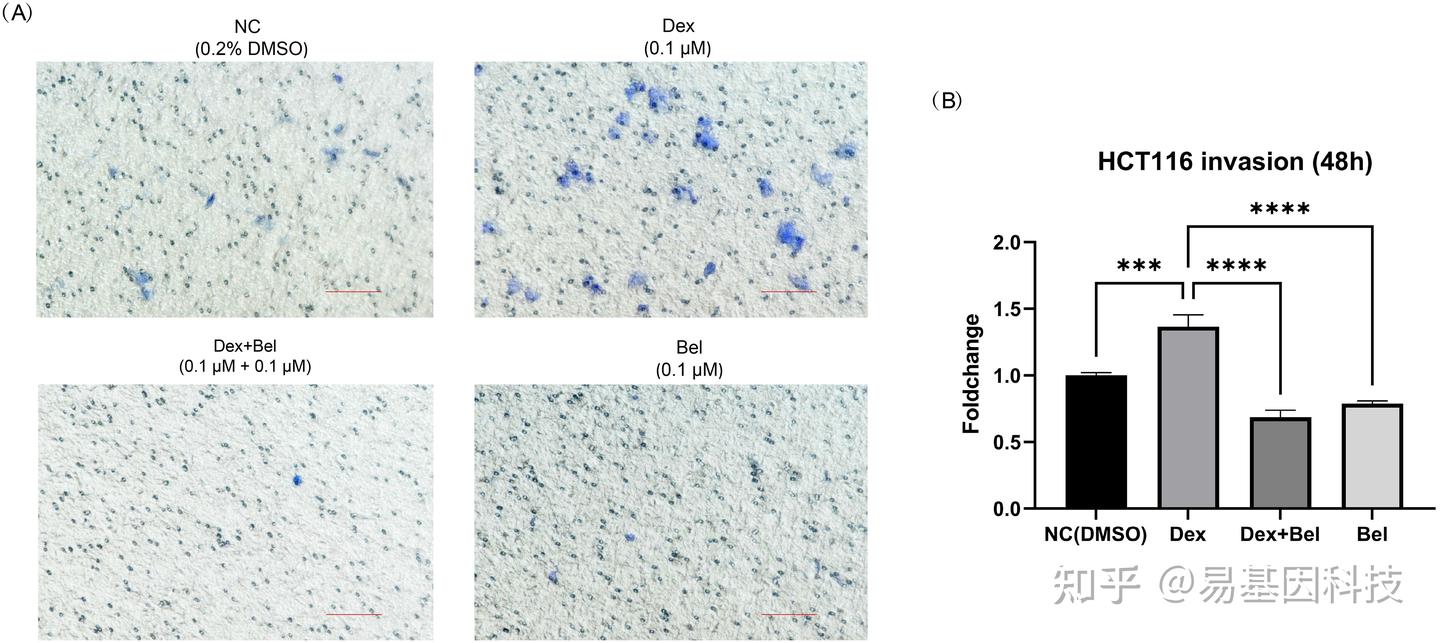
图4:HCT116细胞的侵袭能力。
(5)Belinostat处理诱导与癌症转移相关的靶基因下调。
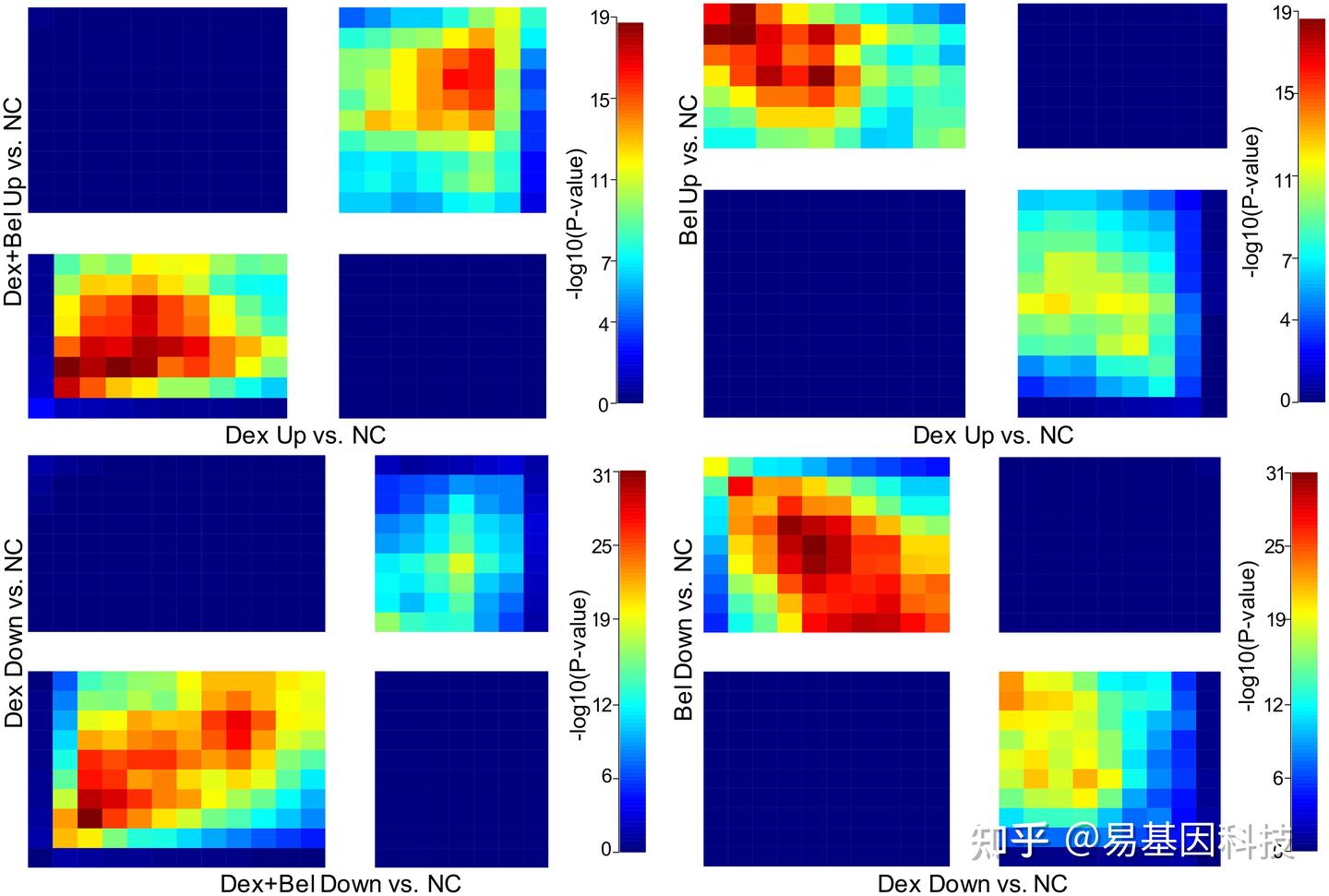
图5 比较迁移(under-layer)细胞系模型中692个上调基因。
易小结:
本研究通过多学科方法整合分子生物学、转录组学、表观遗传学和药物发现,揭示了GCs通过GR和TET2的共同调控促进CRC转移的分子机制,并提出了belinostat作为潜在的辅助治疗手段,并为CRC的新药开发提供了潜在的靶点。
研究亮点
- 揭示了GCs在CRC转移中的分子机制。
- 鉴定了GR与TET蛋白之间的相互作用及其共同调控的基因。
- 通过药物再定位策略,发现了可能对抗GC诱导的CRC细胞侵袭的化合物。
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
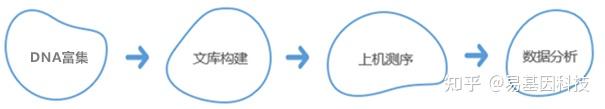
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Song Y, Ren S, Wu S, Liu W, Hu C, Feng S, Chen X, Tu R, Gao F. Glucocorticoid promotes metastasis of colorectal cancer via co-regulation of glucocorticoid receptor and TET2. Int J Cancer. 2024 Dec 11. doi: 10.1002/ijc.35285. PubMed PMID: 39661335.
相关阅读:
项目集锦 | 易基因近期染色质免疫共沉淀测序(ChIP-seq)研究成果
项目文章 | Nat Commun:中南大学曾朝阳/熊炜/龚朝建团队利用ChIP-seq等揭示头颈鳞癌免疫逃逸机制
DNA与蛋白质互作及染色质开放性研究方案
技术推介 | 染色质免疫共沉淀测序 (ChIP-seq)