大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
KRAS基因突变在非小细胞肺癌(NSCLC)中非常常见,尤其是KRAS G12C、G12V、G12D等突变类型。这些突变通常导致KRAS蛋白处于持续激活状态,促进肿瘤发生和发展。然而,KRAS突变与铂类化疗耐药之间的关系尚不清楚。m6A是真核生物mRNA上最丰富的内部修饰之一,由METTL3、METTL14等“writer”蛋白添加,由FTO和ALKBH5等“eraser”蛋白去除。m6A修饰可以调节mRNA的剪切、定位、翻译和稳定性,进而影响基因表达。已有研究表明,m6A修饰在多种癌症的发生和发展中起重要作用,但在KRAS突变型NSCLC的化疗耐药中作用尚不清楚。
近日,美国佛罗里达大学医学系Zhijian Qian团队利用m6A-seq和对应的RNA-seq研究了KRAS突变如何通过调节ALKBH5的翻译后修饰(PTMs),进而影响mRNA的m6A修饰水平,最终导致NSCLC对铂类化疗药物产生耐药性。相关研究成果以“KRAS Mutants Confer Platinum Resistance by Regulating ALKBH5 Post-translational Modifications in Lung Cancer”为题发表于《The Journal of Clinical Investigation》(JCI)。

标题:KRAS Mutants Confer Platinum Resistance by Regulating ALKBH5 Post-translational Modifications in Lung Cancer(KRAS突变通过调节ALKBH5翻译后修饰赋予肺癌的铂类药物耐药性)
发表时间:2025年2月17日
发表期刊:《The Journal of Clinical Investigation》(JCI)
影响因子:IF 13.3/1区
技术平台:m6A-seq(MeRIP-seq)、RNA-seq(易基因金牌技术)
本研究验证了KRAS突变赋予了NSCLC对铂类药物的耐药性。从机制上讲,KRAS突变通过激活ERK/JNK信号通路介导NSCLC细胞对铂类药物的耐药性,该通路通过调节ALKBH5的翻译后修饰(PTMs)抑制了ALKBH5的m6A去甲基化酶活性。结果,KRAS突变导致mRNA m6A甲基化水平整体增加,尤其是DDB2和XPC这两个对核苷酸切除修复至关重要的基因。这种甲基化稳定了这两个基因的mRNA,从而增强了NSCLC细胞修复铂类药物诱导的DNA损伤以及避免凋亡能力,进而导致药物耐受性。此外,通过过表达ALKBH5的SUMO化缺失突变体或药理学抑制METTL3来阻断KRAS突变诱导的m6A甲基化,能够显著增强KRAS突变型NSCLC细胞在体外和体内对铂类药物的敏感性。总体而言,本研究揭示了KRAS突变通过激活ERK/JNK/ALKBH5 PTMs诱导的m6A修饰来调节DNA损伤修复相关基因,从而介导NSCLC细胞对铂类药物的耐药性的表观遗传机制,该机制此前未被认识到。

图形摘要
研究方法与实验设计
细胞模型与药物处理:使用多种细胞模型,包括BEAS-2B(正常支气管上皮细胞)、KRAS野生型NSCLC细胞(NCI-H522)和KRAS突变型NSCLC细胞(NCI-H23)。通过过表达KRAS突变体(G12V)或敲低KRAS,研究其对铂类药物(顺铂)耐药性的影响。
m6A修饰分析:使用m6A-seq技术分析KRAS突变对mRNA m6A修饰的影响。通过m6A免疫沉淀(MeRIP)和RT-qPCR验证特定基因(DDB2和XPC)的m6A修饰水平。
RNA-seq与基因表达分析:通过RNA-seq分析KRAS突变对基因表达的影响,并结合m6A-seq数据,寻找受KRAS突变影响的m6A修饰基因。
体内实验:通过NSCLC细胞的小鼠皮下移植瘤模型,验证KRAS突变对铂类药物耐药性的影响,并检测抑制m6A修饰(如METTL3抑制剂STM2457)是否能逆转耐药性。
关键结果图形
(1)KRAS突变与NSCLC铂类耐药相关
KRAS突变型NSCLC细胞对顺铂化疗药表现出显著的耐药性,表现为DNA损伤减少、细胞凋亡减少和克隆形成能力增强。KRAS突变通过激活ERK/JNK信号通路,抑制ALKBH5的去甲基化酶活性,导致m6A修饰水平整体性升高。
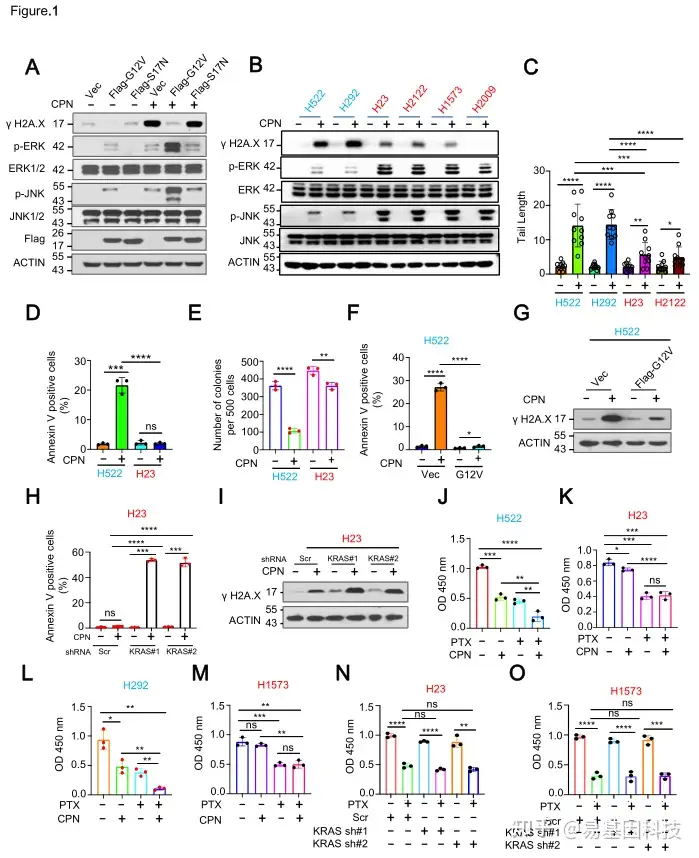
图1:KRAS组成性激活突变导致NSCLC对铂类药物的耐药性。
(2)KRAS突变体通过调控ALKBH5磷酸化和SUMO化来调节整体mRNA m6A甲基化
KRAS突变通过ERK/JNK信号通路诱导ALKBH5的磷酸化(Ser325)和SUMO化(Lys86和Lys321),抑制其去甲基化酶活性。这些修饰导致m6A修饰水平升高,特别是与核苷酸切除修复(NER)相关的基因(如DDB2和XPC)。
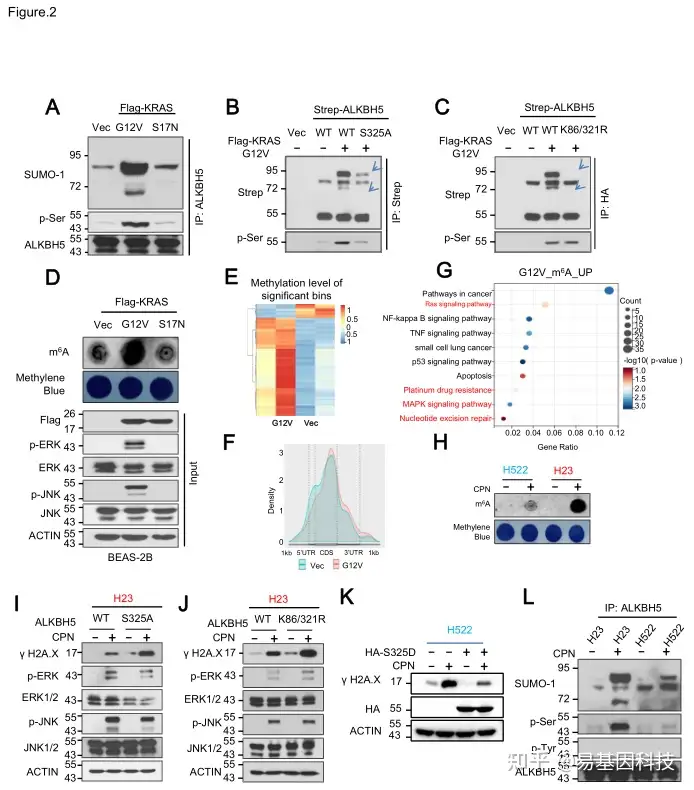
图2. KRAS组成性激活突变通过调节ALKBH5磷酸化和SUMO化调控整体mRNA m6A甲基化。
(3)阻断ALKBH5 SUMO化可以抑制非小细胞肺癌细胞的铂耐药性。
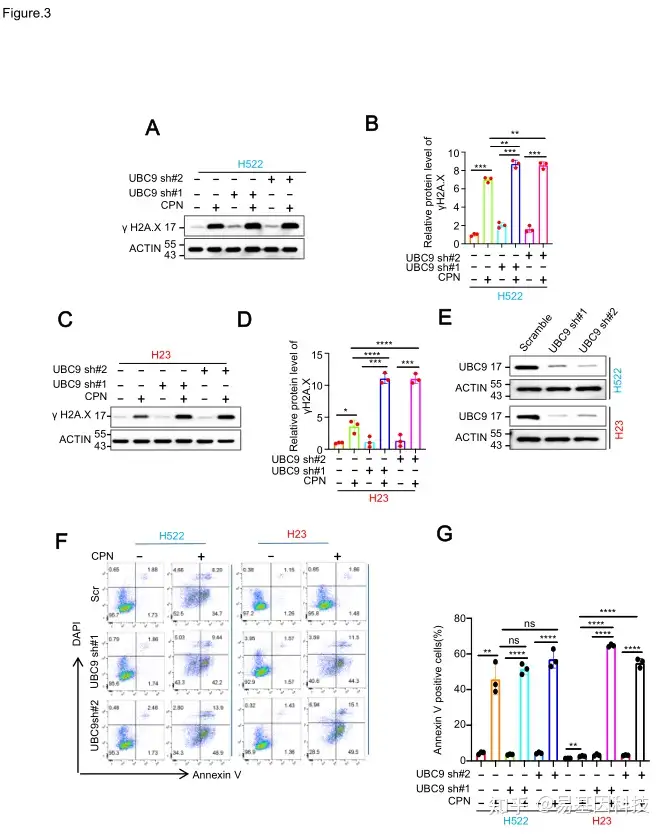
图3:阻断ALKBH5-SUMO化抑制了NSCLC细胞的铂耐药性。
(4)转录组学(RNA-seq)和表观转录组学(m6A-seq)分析确定了核苷酸切除修复相关基因,包括DDB2和XPC,是KRAS突变体的关键下游靶基因。
研究者通过m6A-seq分析了KRAS野生型和KRAS G12V突变型细胞的m6A修饰图谱,发现KRAS突变显著改变了m6A修饰水平。并通过RNA-seq分析了KRAS野生型和KRAS G12V突变型细胞的基因表达谱,发现KRAS G12V过表达导致429个基因表达上调,283个基因表达下调。这些差异表达基因主要富集在RAS和MAPK信号通路、铂类耐药和DNA损伤修复相关通路中。
通过m6A-seq和RNA-seq的联合分析,研究者发现DDB2和XPC是KRAS突变的关键下游靶基因。这些基因的m6A修饰增加导致其表达上升,从而增强了NSCLC细胞的DNA损伤修复能力,促进了铂类化疗耐药。总之KRAS突变通过m6A修饰增加DDB2和XPC的mRNA稳定性,从而增强其表达。这些基因表达增加促进DNA损伤修复,使NSCLC细胞对铂类药物耐药。
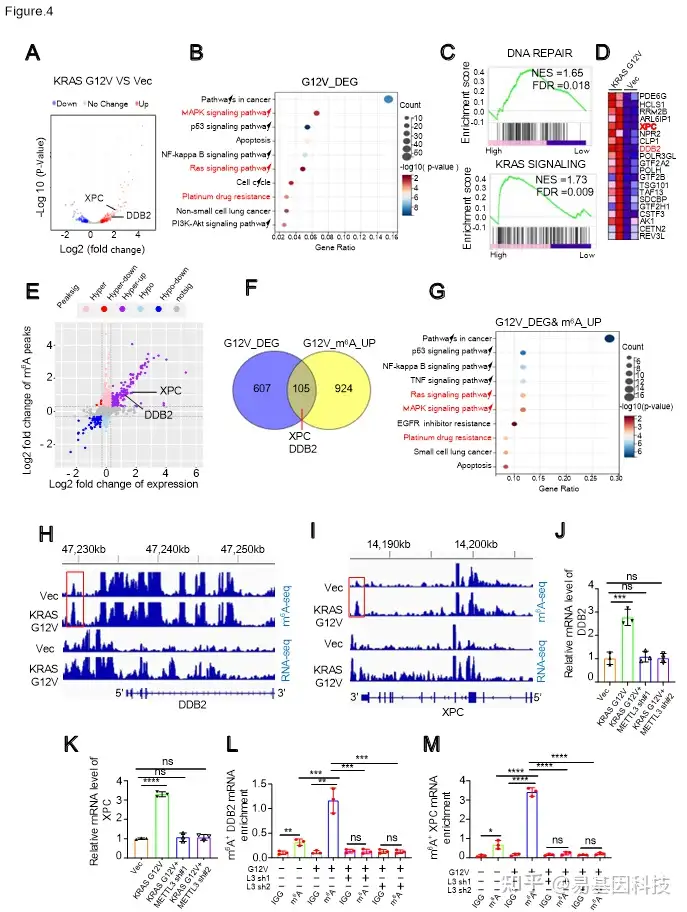
图4. RNA-seq和m6A-seq鉴定出DDB2和XPC是KRAS突变的关键下游靶基因。
- 火山图显示KRAS G12V过表达在NCI-H522细胞中诱导的差异表达基因。
- GO分析KRAS G12V过表达诱导的差异表达基因。
- GSEA图显示在KRAS G12V过表达的NCI-H522细胞中,DNA损伤修复和KRAS信号通路相关基因集的富集情况。
- 热图显示图4C中KRAS G12V过表达诱导的DNA损伤修复相关基因的上调基因列表。
- 基因分布图显示通过m6A-seq鉴定的基因,这些基因在mRNA的m6A甲基化和整体表达方面因KRAS G12V过表达而发生显著变化。
- 维恩图显示在KRAS G12V过表达时,既有显著表达变化又有m6A修饰变化的重叠基因。
- 通过RNA-seq和m6A-seq数据的综合分析,GO分析在NCI-H522细胞中鉴定出KRAS G12V以m6A依赖性方式调控的下游靶基因。
H-I. RNA-seq和m6A-seq峰值可视化:显示对照组和KRAS G12V过表达的NCI-H522细胞中DDB2和XPC转录本的RNA-seq和m6A-seq峰值。
J-K. RT-qPCR分析表明KRAS G12V过表达介导DDB2和XPC上调可通过敲低METTL3挽救。
L-M. MeRIP分析表明KRAS G12V过表达诱导的DDB2和XPC转录本的m6A甲基化水平上调可被METTL3缺失赖抑制。
(5)顺铂/KRAS诱导DDB2和XPC的m6A修饰导致其mRNA稳定
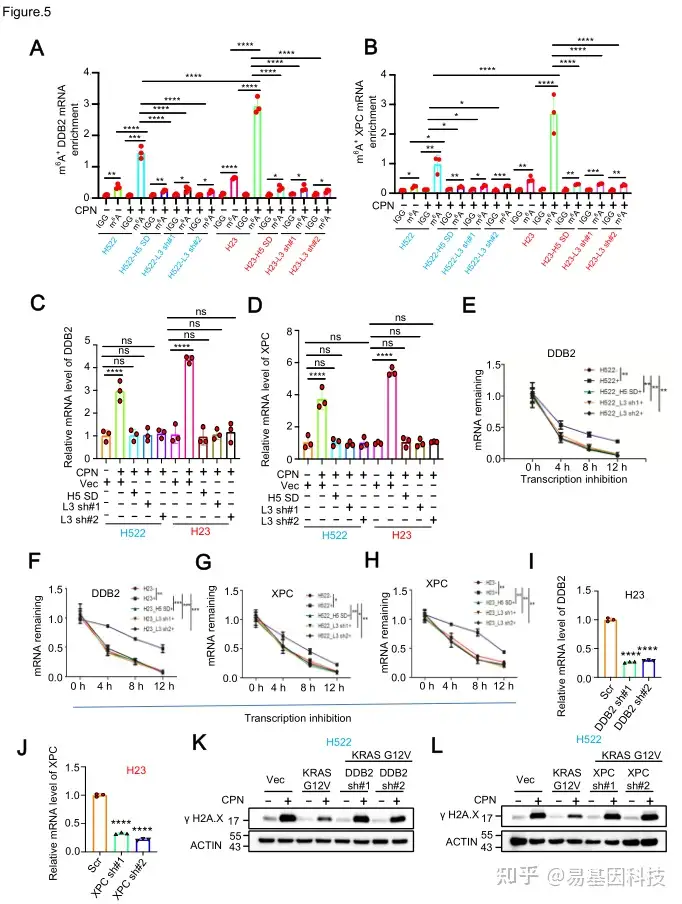
图5:顺铂/KRAS诱导DDB2和XPC的m6A修饰导致其mRNA稳定。
(6)体内实验验证
在裸鼠移植瘤模型中,KRAS突变型NSCLC细胞对顺铂耐药,而过表达SUMO化缺陷型ALKBH5或抑制METTL3可以逆转耐药性。这些结果表明,抑制m6A修饰可以增强KRAS突变型NSCLC细胞对铂类药物的敏感性。
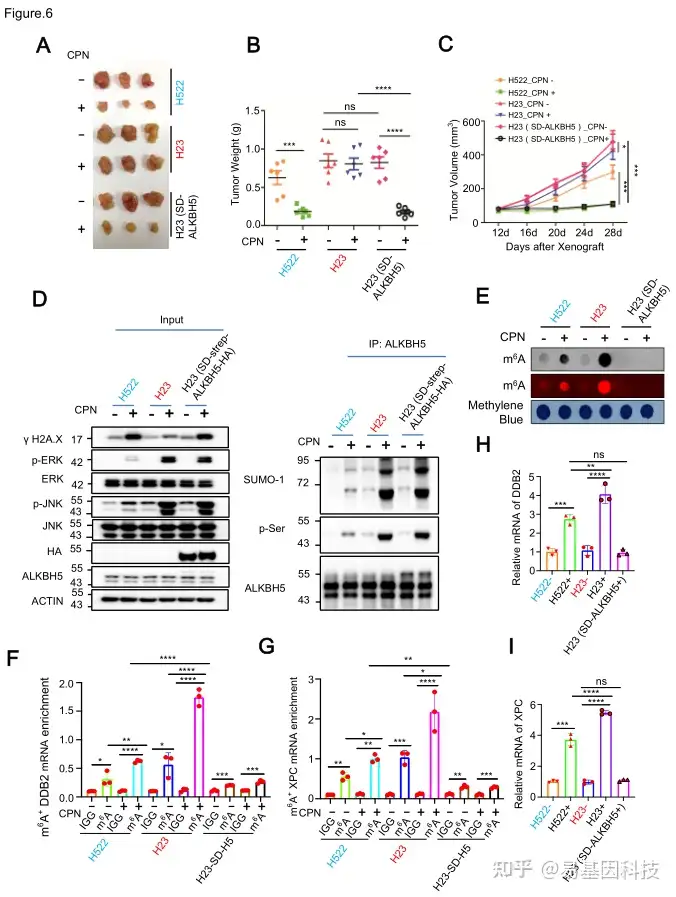
图6:KRAS突变体通过在体内调控AKBH5-PTMs介导的DNA修复通路导致NSCLC耐药性
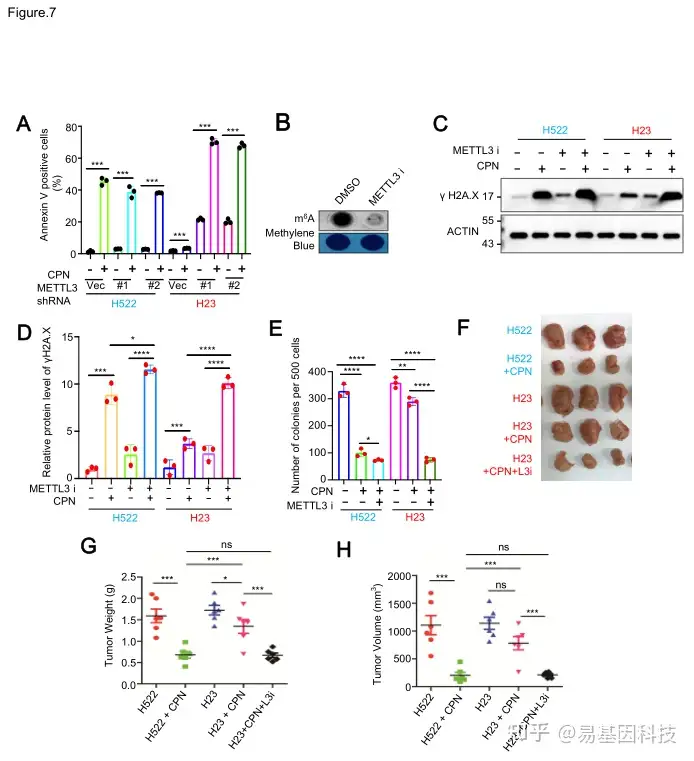
图7:METTL3抑制使携带KRAS突变的NSCLC细胞在体内对顺铂敏感。
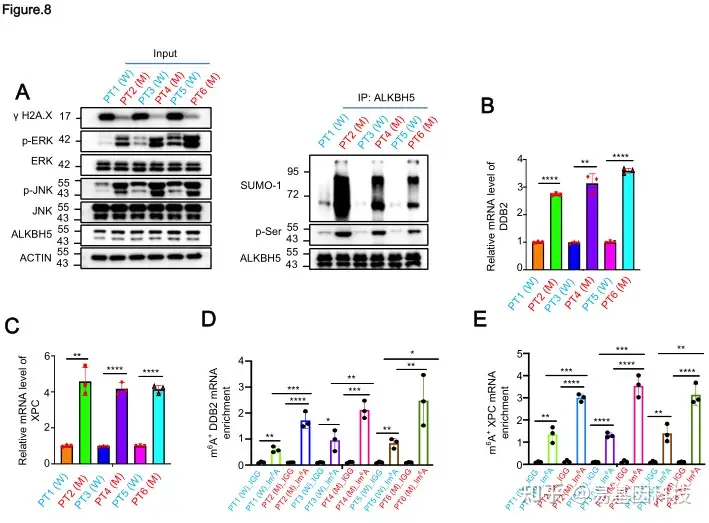
图8:KRAS/ERK/JNK/ALKBH5-PTMs/m6A/DDB2&XPC/核苷酸切除修复信号轴在临床肺癌患者中频繁发生
易小结
本研究通过m6A-seq和对应的RNA-seq揭示了KRAS突变通过激活ERK/JNK信号通路调控ALKBH5的PTMs,进而影响m6A修饰水平,最终通过稳定DDB2和XPC的mRNA,增强DNA损伤修复能力,导致铂类化疗耐药。通过抑制METTL3或过表达SUMO化缺失型ALKBH5可以逆转KRAS突变型NSCLC的铂类耐药性。这为KRAS突变型NSCLC的治疗提供了新靶点和策略。
本研究结果揭示了KRAS突变在NSCLC化疗耐药中的分子机制,为开发新的联合治疗方案提供了理论依据。通过抑制m6A修饰,可能为KRAS突变型NSCLC患者提供更有效的治疗选择。
m6A-seq和RNA-seq在本研究中的重要作用
m6A-seq为本研究提供了m6A修饰的全转录组图谱,揭示了KRAS突变如何通过m6A修饰调控基因表达,尤其是与DNA损伤修复相关的基因(如DDB2和XPC)。
RNA-seq为本研究提供了基因表达的全转录组图谱,揭示了KRAS突变对基因表达的影响,并与m6A-seq结果相结合,进一步证实了m6A修饰对基因表达的调控作用。
两者的联合分析为研究KRAS突变在NSCLC化疗耐药中的分子机制提供了全面的视角,并为开发新的治疗策略提供了重要的靶点(如METTL3和DDB2/XPC)。
通过这两种技术,研究者不仅揭示了KRAS突变的下游效应,还为理解m6A修饰在癌症中的作用提供了新的理论依据。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
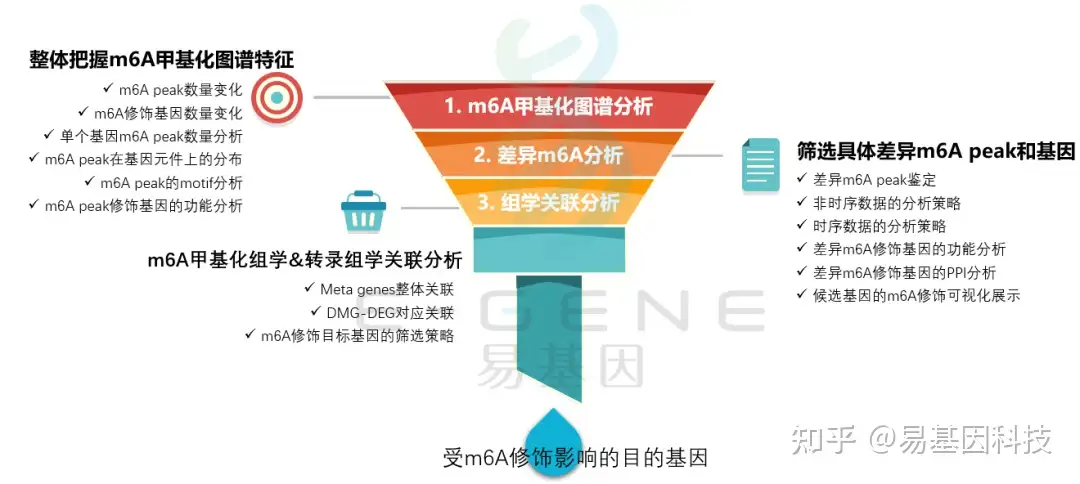
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
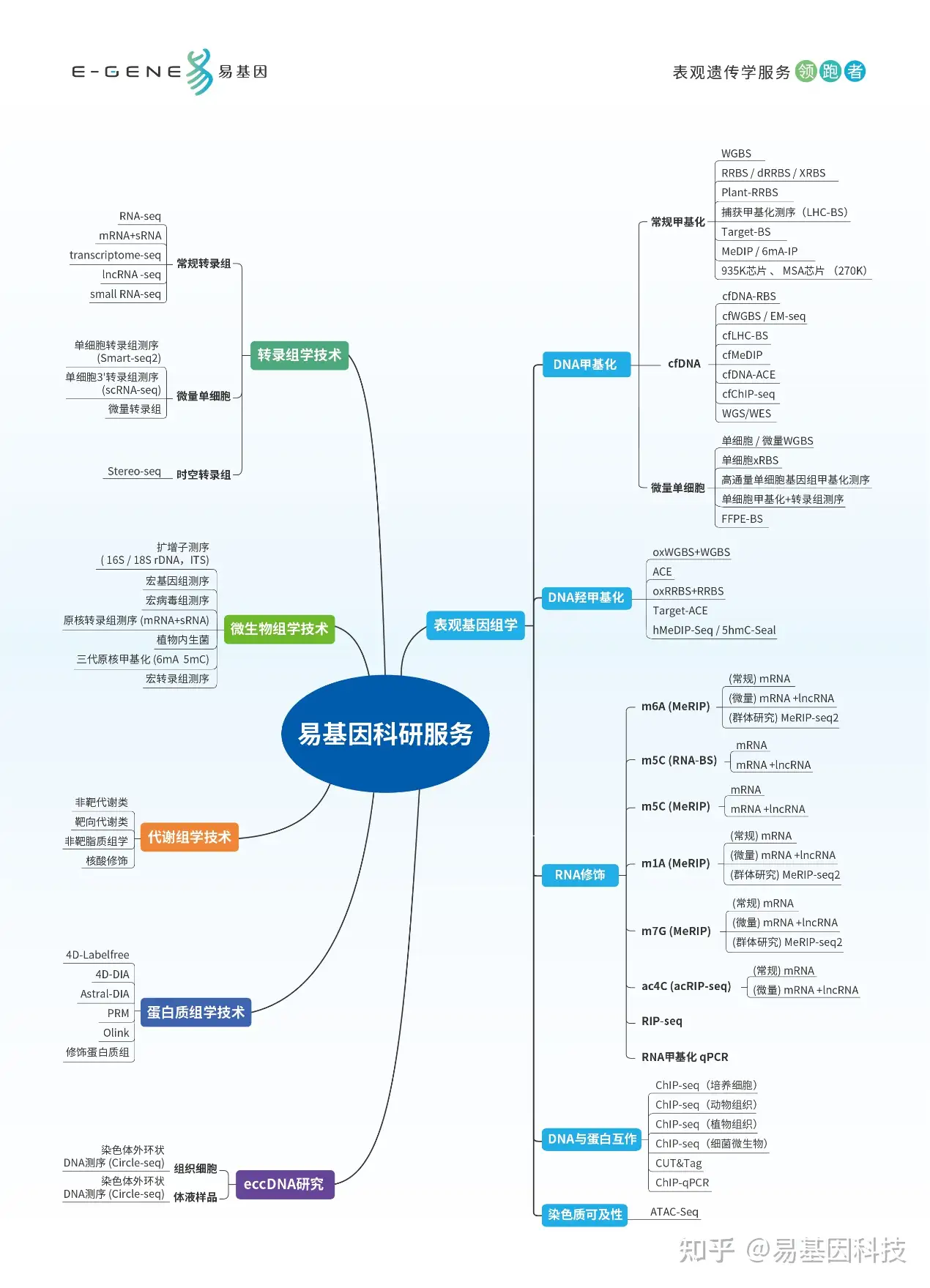
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化、cfDNA)和表观转录组学(m6A、m5C、m1A、m7G、ac4C、RNA与蛋白互作)、DNA与蛋白互作及染色质开放性技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Yu F, Zheng S, Yu C, Gao S, Shen Z, Nar R, Liu Z, Huang S, Wu L, Gu T, Qian Z. KRAS Mutants Confer Platinum Resistance by Regulating ALKBH5 Post-translational Modifications in Lung Cancer. J Clin Invest. 2025 Feb 4. pii: 185149. doi: 10.1172/JCI185149. PubMed PMID: 39960727.
相关阅读:
1、2024项目文章精选:DNA甲基化、RNA甲基化(m6A/m5C)、ChIP-seq、单细胞转录组、宏基因组|年终盘点
2、项目文章 | Adv Sci:NSUN2介导m5C修饰代谢重编程促进肿瘤进展 揭示治疗新选择
3、项目文章 | NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
4、项目文章:MeRIP-seq+RNA-seq揭示不同品种猪肌肉发育的m6A RNA甲基化差异|育种研究
5、项目文章:MeRIP-seq+RNA-seq揭示家禽(鸡)脂肪沉积中的m6A RNA甲基化调控机制
6、项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
7、项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
8、项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
9、一文读懂:八大RNA m⁶A甲基化研究核心问题
10、m6A/m5C/m1A/m7G/ac4C/Ψ等8种RNA修饰的生物学功能和潜在机制 | 深度综述
11、深度综述:癌症中RNA修饰机制的遗传和表观遗传失调(m6A+m1A+m5C+ψ)
12、技术推介|RNA m5C甲基化测序(RNA-BS)
13、技术推介|ac4C乙酰化RNA免疫沉淀测序(acRIP-seq)
14、技术推介|RNA m7G甲基化测序(m7G-MeRIP-seq)
15、技术推介|m1A RNA甲基化测序(MeRIP-seq/m1A-seq)
16、技术推介|RNA m⁶A甲基化测序(MeRIP-seq)技术介绍