今天给同学们分享一篇生信文章“Systematic analysis of the role of SLC52A2 in multiple human cancers”,这篇文章发表在Cancer Cell Int期刊上,影响因子为5.8。

结果解读:
多种人类癌症中SLC52A2的mRNA表达
首先,作者使用GTEx数据库分析了31种正常组织中SLC52A2的表达情况。结果显示,SLC52A2在骨髓、脾脏和睾丸组织中的表达最高,而在骨骼肌、血液和肝脏中的表达最低(图1A)。此外,脂肪组织和骨骼肌组织中SLC52A2的表达在女性中明显高于男性(图1B,C)。随后,作者使用CCLE数据库估计了各种癌细胞系中SLC52A2的表达情况。结果表明,SLC52A2在所有38种肿瘤细胞系中均有表达。具体而言,脑膜瘤细胞系和结肠直肠癌细胞系表达SLC52A2的水平最高,而弥漫性大B细胞淋巴瘤细胞系和T细胞急性淋巴细胞白血病细胞系表达最低。

SLC52A2表达与多种癌症的临床特征的相关性分析
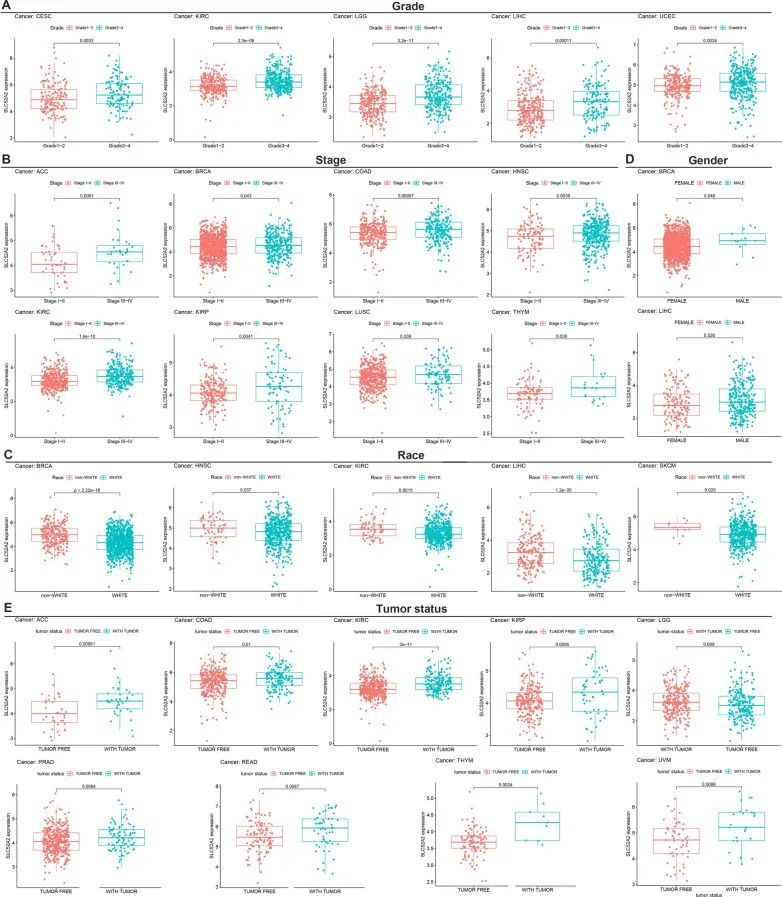
作者使用TCGA数据估计了SLC52A2表达与人类癌症的临床特征之间的关联。作者发现,在CESC、KIRC、LGG、LIHC和UCEC中,SLC52A2的表达在3-4级患者中显著高于1-2级患者(图2A)。在ACC、BRCA、COAD、HNSC、KIRC、KIRP、LUSC和THYM中,作者发现III-IV期患者的表达显著高于I-II期患者(图2B)。至于种族,作者发现在BRCA、HNSC、KIRC、LIHC和SKCM中,非白人人群(夏威夷原住民或其他太平洋岛民、太平洋岛民、黑人或非洲裔美国人、美洲印第安人或阿拉斯加原住民和亚洲人)的患者表达显著高于白人人群(图2C)。作者还发现,在BRCA和LIHC中,SLC52A2的表达在男性中显著高于女性(图2D)。最后,作者分析了SLC52A2表达与肿瘤状态之间的相关性。结果显示,与无肿瘤相比,在ACC、COAD、KIRC、KIRP、LGG、PRAD、READ、THYM和UVM中,存在肿瘤时SLC52A2的表达更高(图2E)。Thorsson等人[18]。发现了六种稳定且可复现的免疫亚型,包括伤口愈合(C1),IFN-γ优势(C2),炎症(C3),淋巴细胞减少(C4),免疫静止(C5)和TGF-β优势(C6),几乎涵盖了所有癌症。这些亚型与预后、遗传和免疫调节改变相关,可能塑造了特定类型的免疫环境。在这里,作者检查了多种癌症中不同免疫亚型中SLC52A2的表达,并发现在BRCA、KIRC、KICH、TGCT、LIHC、LUAD、LUSC、OV、PAAD、PRAD、SARC和STAD中存在显著差异。有趣的是,SLC52A2的表达在C3免疫亚型中最低,在C4免疫亚型中较高。
SLC52A2在多种人类癌症中的预后分析
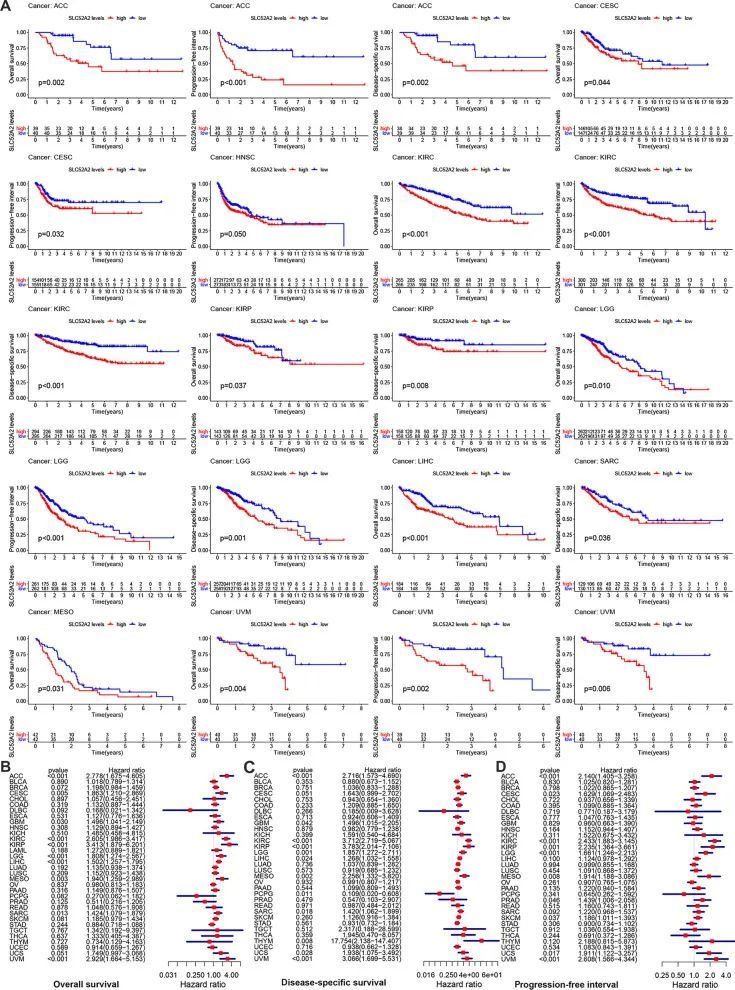
TCGA数据库被用来估计SLC52A2表达与多种人类癌症的生存相关性。通过Kaplan-Meier分析选择33种人类癌症的SLC52A2表达中位数作为分界值,结果显示SLC52A2高表达与ACC(OS,DSS,PFI)、CESC(OS,PFI)、HNSC(PFI)、KIRC(OS,DSS,PFI)、KIRP(OS,DSS)、LGG(OS,DSS,PFI)、LIHC(OS)、SARC(DSS)、MESO(OS)和UVM(OS,DSS,PFI)的不良生存相关,而其他肿瘤间不存在统计学差异(图3A)。
SLC52A2基因突变在多种人类癌症中出现
作者通过cBioPortal数据库分析了SLC52A2在全癌症中的变异频率。结果显示,在10,953名患者中,有691人(6%)的SLC52A2发生了变异。最高的变异频率与扩增相关,其次是深度缺失和突变。在全癌症中,卵巢癌的变异比例最高,为26.2%。进一步展示了SLC52A2基因突变的类型、位点和病例数。在SLC52A2中,作者发现了72个突变位点(包括58个错义突变、9个截断突变、4个融合突变和1个内框突变),这些位点位于氨基酸0到445之间。作者还通过COSMIC数据库进一步分析了SLC52A2基因在多种人类癌症中的突变分布。结果显示,错义突变和协同突变是癌症中主要的突变类型。在SLC52A2编码链中,C > T和G > A突变最为常见,A > G和G > T突变也较为常见。此外,作者通过cBioPortal数据库评估了SLC52A2基因遗传变异与癌症预后之间的相关性。与没有SLC52A2改变的病例相比,SLC52A2水平发生改变的癌症患者在无进展期和无疾病期方面显示出较差的预后。
SLC52A2表达与多种人类癌症中的MSI、TMB和一些常见免疫检查点基因相关联
目前,MSI和TMB状态是肿瘤患者预后的重要指标,可以促进治疗选择,特别是免疫检查点抑制剂(ICIs)的应用[19]。因此,作者估计了全癌中MSI、TMB和SLC52A2表达之间的关系。作者的结果显示,在甲状腺癌(THCA)、胃癌(STAD)、皮肤黑色素瘤(SKCM)、肺鳞状细胞癌(LUSC)、肾癌(KIRC)、肾上腺皮质癌(KICH)、头颈部鳞状细胞癌(HNSC)、食管癌(ESCA)、弥漫大B细胞淋巴瘤(DLBC)和子宫颈癌(CESC)中,SLC52A2表达与MSI呈正相关,但在直肠癌(READ)和结肠癌(COAD)中与MSI呈负相关(图4A)。至于TMB,作者的结果还表明,SLC52A2表达与13种人类癌症的TMB显著相关。其中,SLC52A2的表达与12种癌症类型的TMB呈正相关,包括肾上腺皮质癌(ACC)、胃癌(STAD)、肉瘤(SARC)、前列腺癌(PRAD)、胰腺癌(PAAD)、肺鳞状细胞癌(LUSC)、肺腺癌(LUAD)、低级别胶质瘤(LGG)、肾癌(KIRC)、食管癌(ESCA)、乳腺癌(BRCA)和膀胱癌(BLCA)。相反,在结肠癌(COAD)中,SLC52A2的表达与TMB呈负相关(图4B)。此外,作者还使用TCGA数据库的mRNA序列数据评估SLC52A2表达与一些常见免疫检查点基因之间是否存在关联。结果显示,在KICH、KIRC、KIRP、LGG、LIHC和UVM中检测到SLC52A2和大多数免疫检查点基因的显著共表达(图4C)。
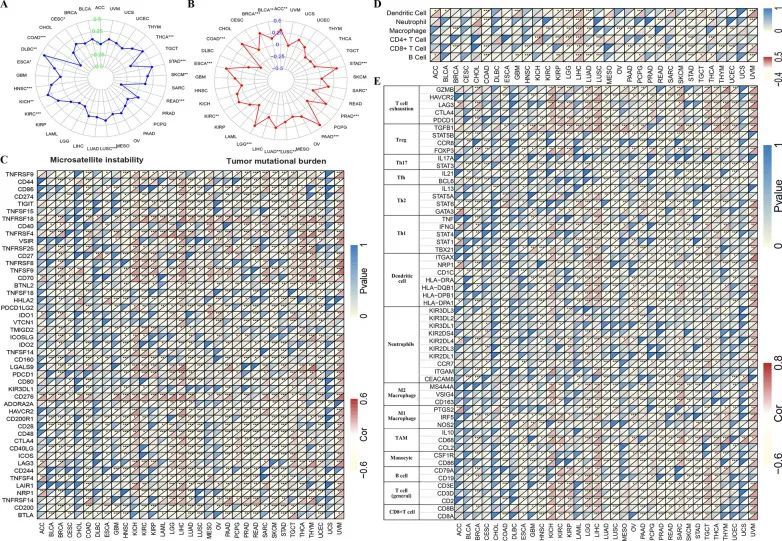
SLC52A2表达与多种人类癌症中免疫细胞浸润的关联
众所周知,免疫细胞在免疫微环境中起着非常重要的作用,并且可以影响癌症患者的预后。在这里,作者进一步通过TIMER数据库分析了SLC52A2表达与6种免疫相关细胞浸润之间的相关性。结果显示,在KIRP、LGG和LIHC中,SLC52A2与大多数免疫细胞浸润呈正相关(图4D)。作者进一步探讨了SLC52A2与不同功能性免疫浸润细胞的关系,包括T细胞(总体、CD8、Th1、Th2、Tfh、Th17、Treg和T细胞耗竭)、B细胞、单核细胞、肿瘤辅助巨噬细胞(TAMs)、M1和M2巨噬细胞、中性粒细胞和树突状细胞。如图4E所示,作者非常兴奋地观察到在BLCA、KICH、KIRC、KIRP、LGG、LIHC、PCPG、SARC、TCGT、THCA、THYM和UVM中,SLC52A2与T细胞耗竭的分子标志物之间存在强烈的正相关。此外,在KICH、LIHC、SARC和UVM中,SLC52A2与TAMs和M2巨噬细胞的分子标志物也显示出显著的正相关。因此,SLC52A2可能在癌症微环境中的免疫逃逸和巨噬细胞M2极化中发挥关键作用。此外,根据CIBERSORT算法,分析了SLC52A2表达与22种免疫细胞浸润在各种肿瘤中的相关性。作者的结果与上述发现大致一致。例如,结果显示SLC52A2与HNSC、LGG、LIHC、SARC和THYM中M2巨噬细胞浸润水平呈正相关。作者还发现,在BRCA、KIRC、KIRP、LGG、LIHC、LUAD、PAAD、PCPG、PRAD和STAD中,与免疫逃逸有关的调节性T细胞浸润水平与SLC52A2表达呈正相关。值得注意的是,使用TIDE算法,作者发现在大多数肿瘤中,髓源性抑制细胞的浸润水平与SLC52A2的表达呈正相关。总之,作者发现SLC52A2与促癌免疫微环境的形成密切相关。
SLC52A2相关基因富集分析
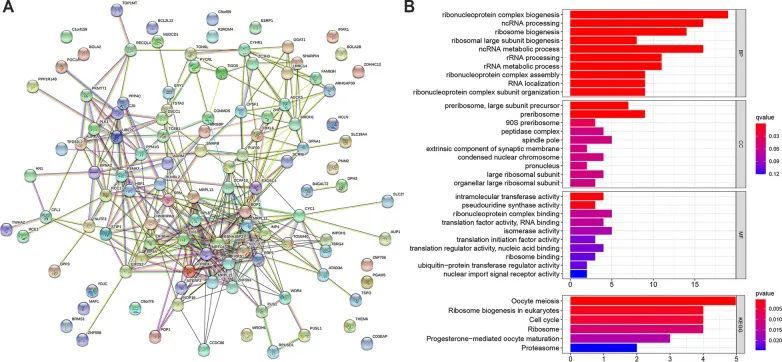
为了进一步探索SLC52A2在肿瘤发生中的作用,作者使用GEPIA2工具获得了与SLC52A2表达高度相关的114个基因(R > 0.4)。然后,使用STRING工具构建了上述基因的蛋白质相互作用网络(图5A)。作者进一步进行了KEGG和GO富集分析。经过GO富集分析的筛选,作者发现了图5B中显示的几个富集基因集。生物过程(BP)主要富集在“核糖核蛋白复合物生物合成”、“非编码RNA加工”、“非编码RNA代谢过程”和“核糖体生物合成”方面。对于细胞组分(CC)的结果表明,这些基因主要与“前核糖体大亚基前体”和“前核糖体”相关。此外,在分子功能(MF)分析中,发现这些基因与“分子内转移酶活性”相关。图5B的KEGG数据显示,“卵母细胞减数分裂”、“真核生物核糖体生物合成”、“细胞周期”和“核糖体”可能参与了SLC52A2对肿瘤发病机制的影响。
SLC52A2表达与LIHC之间的关系分析
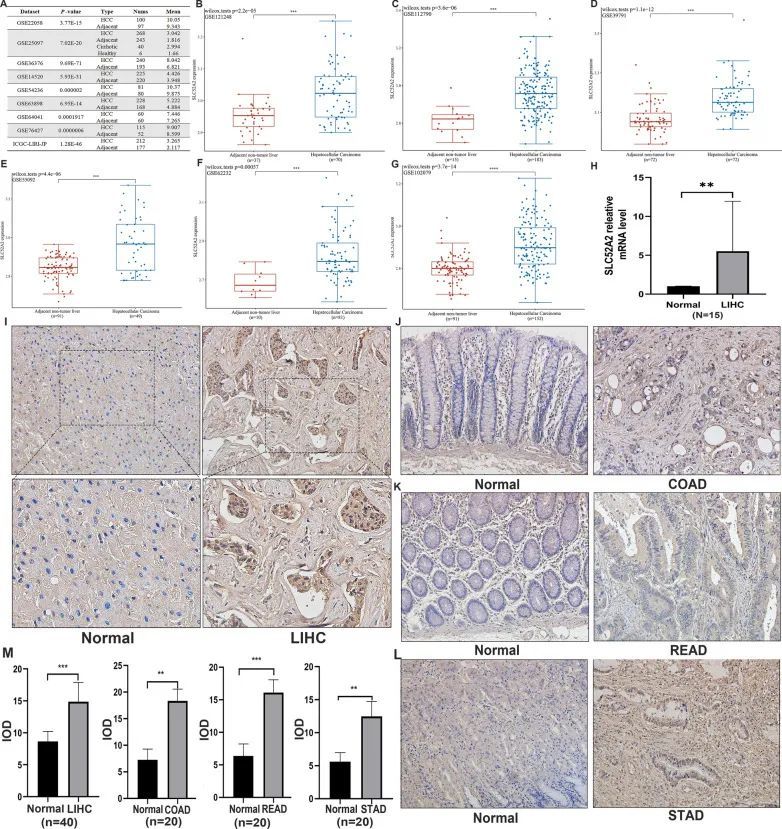
从上述分析中发现,SLC52A2与LIHC的预后密切相关。因此,作者对SLC52A2和LIHC之间的相关性进行了更深入的研究。作者首先使用TCGA数据库对LIHC进行了成对差异分析,结果继续显示,肿瘤中SLC52A2的表达比癌旁组织高得多。接下来,作者使用HCCDB数据库验证了SLC52A2的表达情况(包括GSE22058、GSE25097、GSE36376、GSE14520、GSE54236、GSE63898、GSE64041、GSE76427和ICGC-LIRI-JP数据集),GSE121248、GSE112790、GSE39791、GSE55092、GSE62232和GSE102079数据集,结果显示SLC52A2在LIHC中高度表达(图6A-G)。作者还通过qRT-PCR分析验证了SLC52A2的mRNA表达,使用肝细胞癌和癌旁冰冻组织,结果与上述一致(图6H)。最后,作者使用免疫组化(IHC)进一步评估了SLC52A2的表达情况。IHC染色显示SLC52A2在LIHC中显著上调(图6I,M)。此外,作者在STAD、READ和COAD中也得到了类似的结果(图 6J-M)。根据免疫组化分析,40名患者被分为低SLC52A2表达组(n = 20)和高SLC52A2表达组(n = 20)。LIHC中的详细临床病理特征总结在表格2中。卡方分析显示,男性患者(P = 0.034)和肿瘤较大的患者(P = 0.043),肿瘤分化差的患者(P = 0.025),TNM分期III-IV的患者(P = 0.157),血管侵犯(P = 0.236)似乎表现出更高的SLC52A2表达。
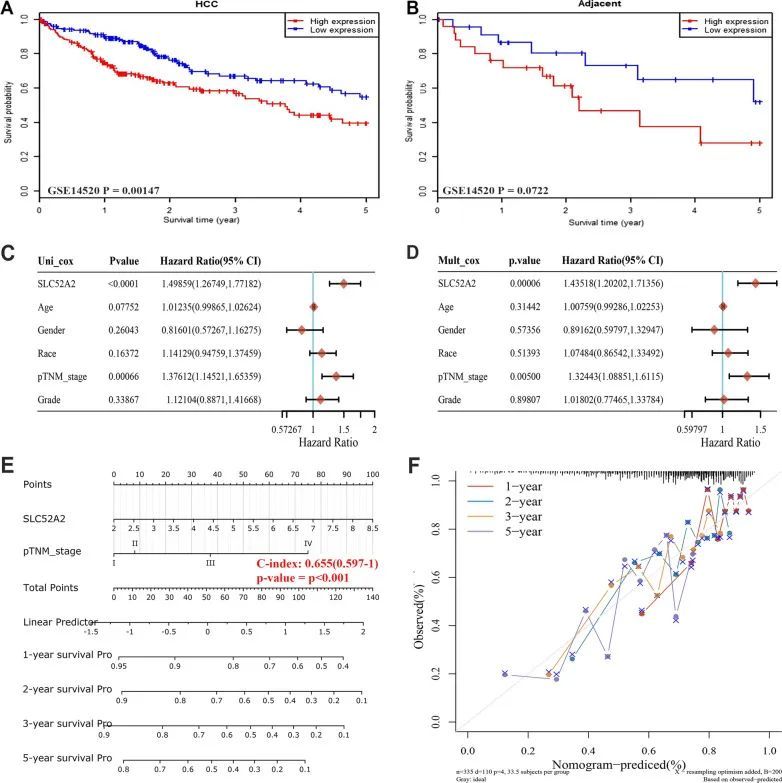
作者还使用GSE14520数据集验证了SLC52A2与LIHC患者预后的关系,结果显示肿瘤组织中SLC52A2的高表达与患者预后不良相关(图7A、B)。因此,作者进一步探讨了SLC52A2是否是LIHC患者的独立预后因子,使用TCGA数据进行分析。如图7C、D所示,SLC52A2的表达与LIHC的OS显著相关,单变量和多变量Cox回归分析表明SLC52A2的表达是LIHC预后的独立预测因子。为了建立一个能够预测LIHC患者生存概率的临床应用方法,作者进行了预测模型的诺莫图分析(C-index: 0.655(0.597–1), P < 0.001),考虑了SLC52A2的表达和临床病理特征,预测了1年、2年、3年和5年的OS概率(图7E)。与理想模型相比,1年、2年和3年的OS率的校准曲线预测效果良好(图7F)。除了LIHC,作者还发现SLC52A2是CESC、KIRC和KIRP的独立风险因子。
预测和分析LIHC中SLC52A2的上游lncRNA和miRNA
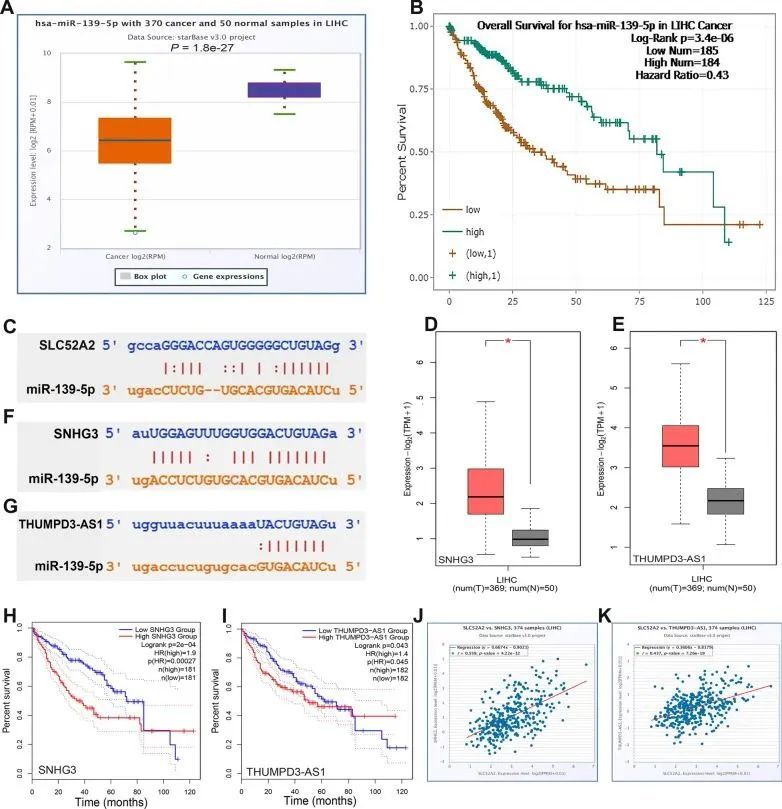
众所周知,非编码RNA(ncRNA)负责调控基因表达。为了确定SLC52A2是否受特定的ncRNA调控,作者首先使用starBase数据库预测可能与SLC52A2结合的上游miRNA,最终确定了13个与之显著相关的miRNA。然而,根据miRNA在调控靶基因表达的作用机制,miRNA与SLC52A2之间应该存在负相关关系。因此,作者认为具有最大负相关系数的hsa-miR-122-5p(R = -0.473)和hsa-miR-139-5p(R = -0.449)可能是SLC52A2的上游miRNA。如图8A、B所示,肿瘤中hsa-miR-139-5p的表达水平要低得多,并且低表达与预后不良密切相关。图8C显示了使用StarBase数据库对SLC52A2序列和hsa-miR-139-5p序列进行的匹配分析。虽然hsa-miR-122-5p的表达在癌症中也较低,并且预后分析发现其高表达与预后不良相关,这与SLC52A2和预后之间的关系相矛盾。因此,作者推测hsa-miR-139-5p是SLC52A2最可能的上游miRNA。
总结
总之,作者的研究表明,SLC52A2在几乎所有肿瘤中都高表达,并与大多数癌症的不良预后、诊断、突变、TMB、MSI、常见免疫检查点基因和免疫细胞浸润有关。它可能通过参与卵母细胞减数分裂、真核细胞核糖体生物发生和细胞周期来促进癌症的进展。此外,SLC52A2的表达是LIHC的独立预后因素,SNHG3和THUMPD3-AS1/hsa-miR-139-5p-SLC52A2轴可能是LIHC中潜在的调节途径。