摘要|临床宏基因组下一代测序(mNGS)是对患者样本中微生物和宿主遗传物质(DNA和RNA)的综合分析,目前正迅速从研究向临床实验室发展。这种新兴的方法正在改变医生诊断和治疗传染病的方式,其应用涉及广泛的领域,包括抗菌素耐药性、微生物组、人类宿主基因表达(转录组学)和肿瘤学。在这里,我们重点关注在临床实验室实施mNGS的挑战,并解决潜在的解决方案,以最大限度地提高其对患者护理和公共卫生的影响。

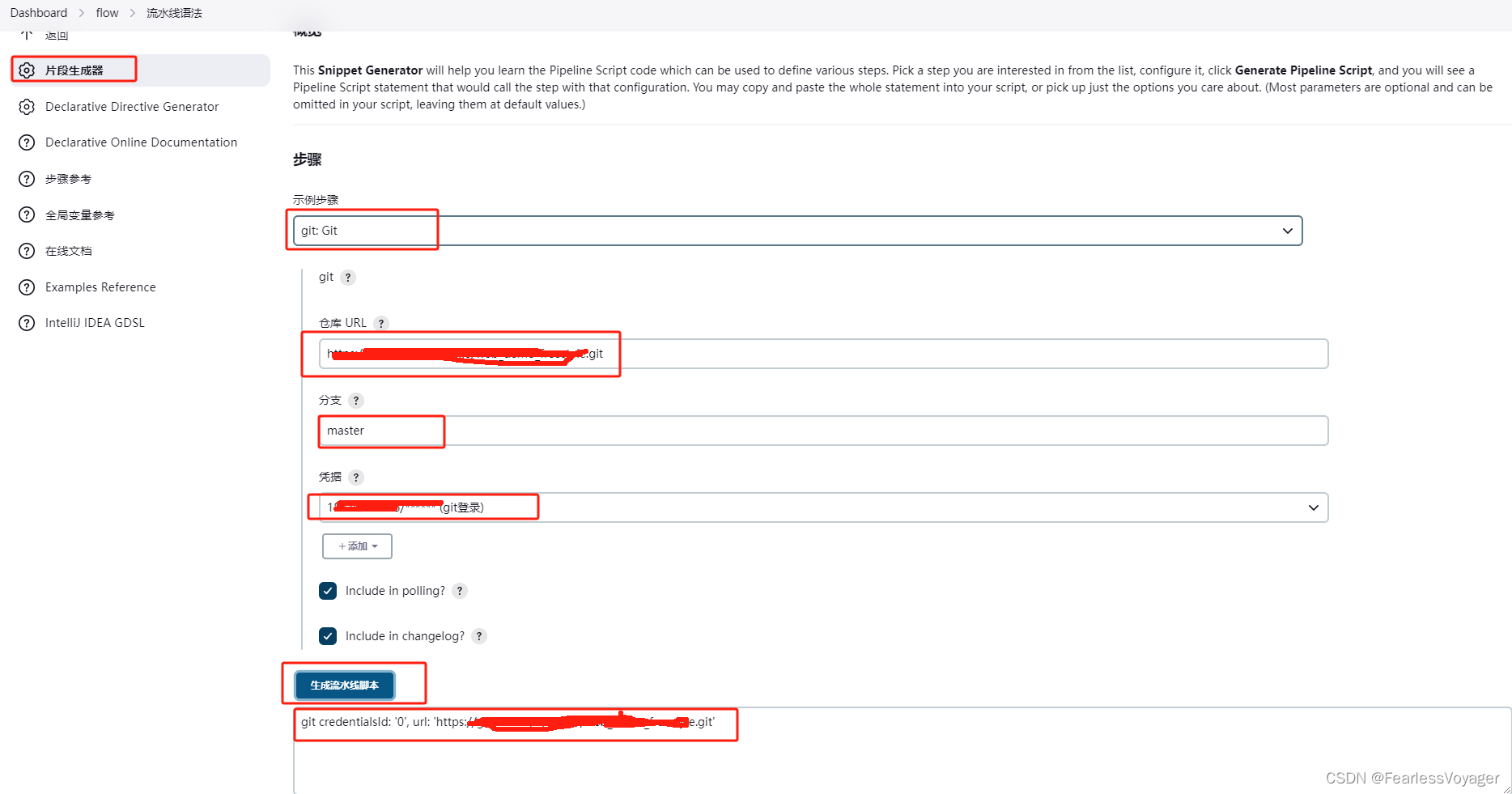
图1|宏基因组测序的临床应用。|在传染病诊断中的应用包括从初级临床样本中直接识别微生物(部分Aa);通过鉴定耐药基因(Ab部分)预测抗菌素耐药性;检测物种水平或菌株水平的毒力决定因素,如特定内毒素或外毒素的分泌(Ac部分);以及抗病毒耐药性预测(Ad部分)。如HIV-1所示,通过宏基因组下一代测序(mNGS)从患者样本中恢复完整的病毒基因组,有助于序列分析预测抗逆转录病毒药物的敏感性或耐药性;分析菌株的敏感性谱预测对非核苷逆转录酶抑制剂(NNRTI)类药物的耐药性(星号表示),而不是核苷逆转录酶抑制剂(NRTIs)或蛋白酶抑制剂(PIs)。B|微生物组分析可以告知急性和慢性疾病状态下的疾病预后,并为益生菌疗法的发展奠定基础。彩色条代表单个微生物群物种。物种多样性的减少见于生态失调(一种不健康的状态),如出现在艰难梭菌相关性疾病的患者中。健康个体的粪便可通过粪便移植或口服粪便包封丸治疗艰难梭菌感染患者。另外,从健康个体中观察到的微生物群物种产生的合成粪便可以作为益生菌来治疗患者。除了艰难梭菌感染外,慢性疾病,如肥胖、炎症性肠病和糖尿病,都是益生菌治疗的潜在靶点。基于C|rna测序的转录组学可以提高基于人类宿主反应的感染性和非感染性疾病的诊断。NGS的宿主转录组分析可以构建一个分类器度量,以高精度区分感染患者(红色条)和未感染患者(蓝条)(部分Ca)。虚线以上的度量分数表示感染,而虚线以下的分数表示没有感染;所显示的分类器度量的总体准确率为83%。聚类热图分析确定了与感染相关的个体差异表达的宿主基因(基因A-F)与与无感染相关的宿主基因(基因G-L)(部分Cb)。D病毒肿瘤的|测序或肿瘤学中的液体活检分析可用于同时检测病原体和表征宿主基因突变。mNGS可用于检测默克尔细胞多瘤病毒,这是一种与默克尔细胞癌的发展相关的病毒。同时对宿主DNA进行测序,可以识别出由于包含全长大T抗原(LT)的病毒基因组整合,随后截断LT抗原(Da部分)或在病毒基因组整合之前截断LT抗原(Db部分)而产生的突变。这两种突变都会导致细胞转化,从而驱动肿瘤的增殖。尽管很有希望,但许多这些基于测序的应用尚未被纳入常规临床实践。C部分改编自参考文献。(https://creativecommons.org/licenses/by-nc-nd/4.0/).D部分改编自参考文献。CC(https://creativecommons.org/licenses/by/3.0/)。
传染病诊断
传统的传染病临床诊断模式,应用了一个多世纪,包括医生制定鉴别诊断,然后命令一系列测试(通常是“一个错误,一个测试”),以试图识别病原体。临床样本常规检测病原体的光谱范围从培养中微生物的识别(例如,通过生化表型测试或matil-辅助激光解吸/电离(MALDI)time-飞行质谱),检测生物体-特定生物标志物(如乳胶凝集抗原检测或抗体检测酶-连接免疫吸附试验(ELISA))或核酸单剂PCR检测使用综合征面板进行多路PCR检测。这些小组通常包括与一种已确定的临床综合征相关的最常见的病原体,如脑膜炎和脑炎、急性呼吸道感染、脓毒症或腹泻病。
分子诊断分析提供了一个相当成本-有效和快速(通常<2小时的周转时间)手段来诊断最常见的感染。然而,目前使用的几乎所有传统微生物试验一次只能检测一组或有限的病原体,或要求从临床样本中成功培养一种微生物。相比之下,虽然NGS分析目前使用不能与传统测试对速度测序运行标准的仪器需要>18小时,使广泛的病原体病毒、细菌、真菌和/或寄生虫识别从文化或直接从临床样本的基础上唯一可识别的DNA和/或RNA序列。NGS方法的另一个关键优势是,测序数据可以用于其他分析,而不仅仅是识别病原体,如微生物组特征和通过RNA测序(RNA-序列)转录组分析人类宿主反应。因此,NGS在诊断的临床效用可能是最困难的-诊断病例或免疫功能低下的患者,潜在的致病菌谱更大。最终,mNGS可能会与多路检测方法具有成本竞争力,或被用作预先“排除”以排除感染性病因的检测方法。当然,无论是检测核酸,无论是通过多重PCR面板还是NGS,本身都不能证明一种已识别的微生物是疾病的原因,研究结果必须在临床背景下进行解释。特别是,在临床样本中发现一种非典型的或新的感染源随后进行了验证性调查,如组织活检样本的正交检测和血清转化的演示,或酌情通过使用细胞培养或动物模型,以确定其真正的致病潜力。在研究或临床实验室进行的临床样本的NGS涉及许多步骤,包括核酸提取、DNA和/或RNA的富集、文库制备、PCR扩增(如果需要)、测序和生物信息学分析(图2)。任何产生足够核酸的体液或组织都可以进行NGS分析,这既可以靶向,即富集单个基因或基因组区域,也可以非靶向,如宏基因组“猎枪”方法(图2)。具体步骤的细节因实验室而异,在其他地方也有广泛的描述。
临床微生物组分析
许多研究人员现在使用mNGS而不是16S rRNA基因的靶向测序来进行微生物组的-深度表征。公众对微生物群及其可能参与急性和慢性疾病状态的认识日益提高。然而,没有基于微生物组-的检测被临床验证用于疾病的诊断或治疗,部分原因是对微生物组的复杂性及其在疾病发病机制中的作用的了解不完全。微生物组分析的一个未来临床应用可能是在艰难梭菌-相关疾病的管理和治疗中。C. 艰难梭菌是一种机会性细菌,可以感染肠道,导致产生毒素,可导致腹泻、脱水、败血症和死亡。C. 艰难感染只发生在微生物群的设置改变等因素暴露于广谱抗生素或最近胃肠手术。微生物群的重要性 C. 粪便粪便移植在治疗和潜在治愈疾病方面的有效性为80-90%。在多项研究中使用mNGS来描述微生物组促进了细菌益生菌混合物的发展,可作为预防或治疗的 C. 艰难-相关疾病(图1B)。
微生物组的另一个潜在应用是对细菌多样性的分析,这可以提供线索,说明病人的疾病是传染性的还是非传染性的。例如,一项用于mNGS识别肺炎患者呼吸道病原体的研究发现,经培养-证实感染的个体呼吸微生物组的多样性明显较低。微生物群的改变,即生态失调,也被证明与肥胖、糖尿病和炎症性肠病是相关的,以及对微生物组的操纵可能是治疗这些病理状况的一个途径。
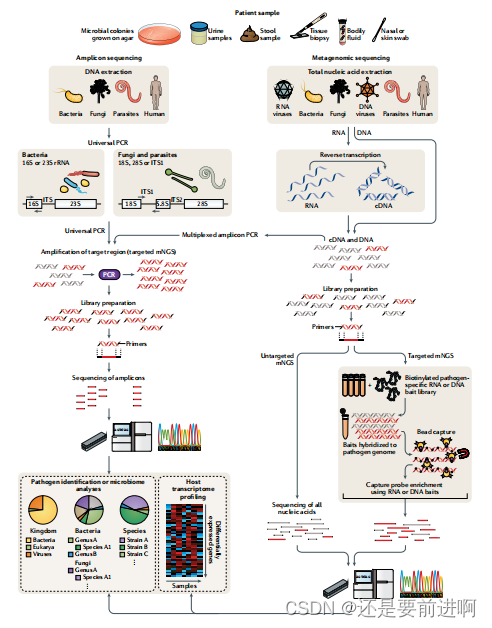
图2|靶向与非靶向猎枪宏基因组下一代测序方法。多种患者样本,以及培养的微生物菌落,可以使用靶向或非靶向的下一代宏基因组测序(mNGS)方法进行分析,用于病原体鉴定、微生物组分析和/或宿主转录组分析。通用PCR(左)是一种有针对性的mNGS方法,使用引物从保守区域设计,如核糖体RNA(rRNA)基因,这些基因在细菌(16S或23S rRNA)或真菌和寄生虫(18S rRNA、28S rRNA或内部转录间隔区(ITS))中普遍保守。其他一组的引物可以被设计为针对一组已定义的病原体和/或基因,并用于多重逆转录PCR或PCR(多路扩增子PCR)。NGS文库的制备和测序产生的扩增子使病原体鉴定到属或种水平。宏基因组测序(右)需要对临床样本中存在的所有微生物和宿主核酸进行无偏不倚的散弹枪测序。构建单独的DNA和RNA文库;DNA文库用于细菌、真菌、DNA病毒和寄生虫的鉴定,而RNA文库用于RNA病毒的鉴定和基于RNA测序的人类宿主转录组分析(热图,右下)。由于在无偏倚的mNGS中没有使用引物或探针,绝大多数的reads对应于人类宿主,因此,从宏基因组文库中检测病原体是一种“大海捞针”的工作。使用磁珠的可选捕获探针富集步骤使宏基因组库中病原体和/或基因的靶向mNGS。所有这些方法都与传统的台式仪器上的测序兼容,如Illumina HiSeq和便携式纳米孔测序仪,如牛津纳米孔技术MinION。

图3|在临床环境中常规部署宏基因组测序的挑战。在该过程的每一步,在实施诊断感染的临床宏基因组管道时,必须考虑多种因素(要点),以最大限度地提高准确性和临床相关性。特别是,作为临床微生物测序委员会的一部分,解释和讨论宏基因组下一代测序(mNGS)检测的结果通常是有用的。
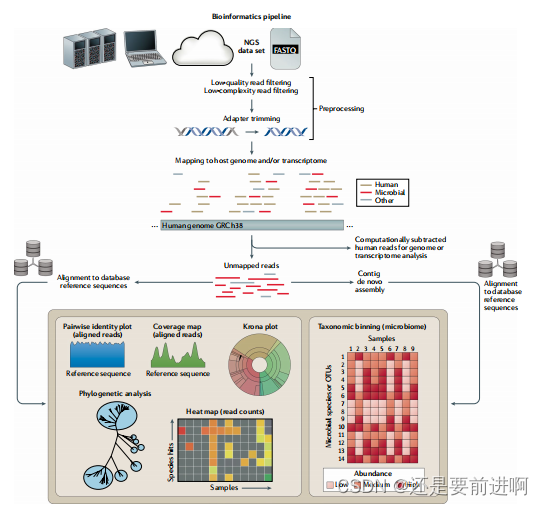
图4|:一个典型的下一代宏基因组测序生物信息学管道。下一代测序(NGS)数据集,通常以FASTQ或序列比对图(SAM)格式进行分析,可以在计算服务器、便携式笔记本电脑或台式计算机或云上进行分析。初始预处理步骤包括低质量滤波、低复杂度滤波和适配器修剪。计算宿主减法是通过将reads映射到宿主(例如,人类)基因组,并将宿主reads用于后续的转录组(RNA)或基因组(DNA)分析来进行的。其余的未映射reads直接与大型参考数据库对齐,如国家生物技术信息中心(NCBI)GenBank数据库或微生物参考序列或基因组收集,或首先从头组装成更长的连续序列(序列),然后对齐参考数据库。在分类分类之后,将个体读取或序列分配到特定的分类单元(例如,种、属和科),数据可以以许多不同的格式进行分析和可视化。这些包括覆盖图和成对识别图,以确定有多少微生物基因组被恢复以及它与数据库中参考基因组的相似性;Krona图可视化宏基因组库中的分类多样性;系统发育分析将组装的基因、基因区域或基因组与参考序列进行比较;热图显示在临床样本中检测到的微生物。OTU,操作分类单元。
这篇文章介绍了宏基因组学在临床应用的挑战和解决方案,介绍的很细致,偏向于临床微生物方方向。我只是针对性介绍了一部分,还是有道翻译的,质量很不好,望见谅。大家有兴趣可以读一读。也可去重磅综述 | Nature子刊:临床宏基因组学(mNGS)的应用与挑战,这个链接中去阅读全文。