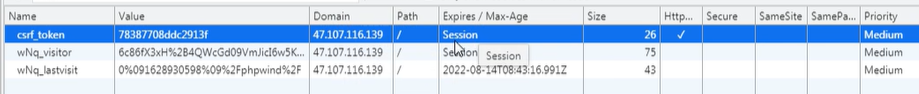
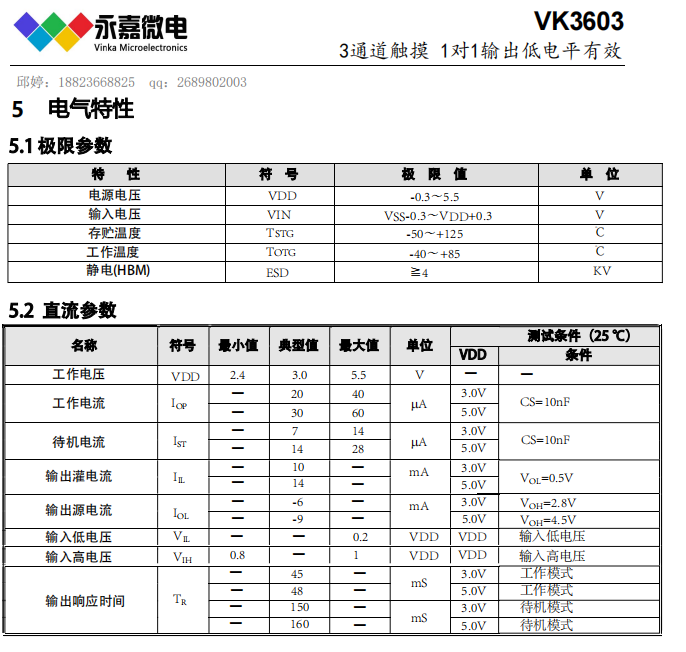
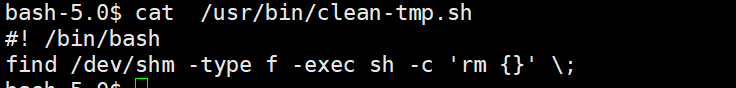
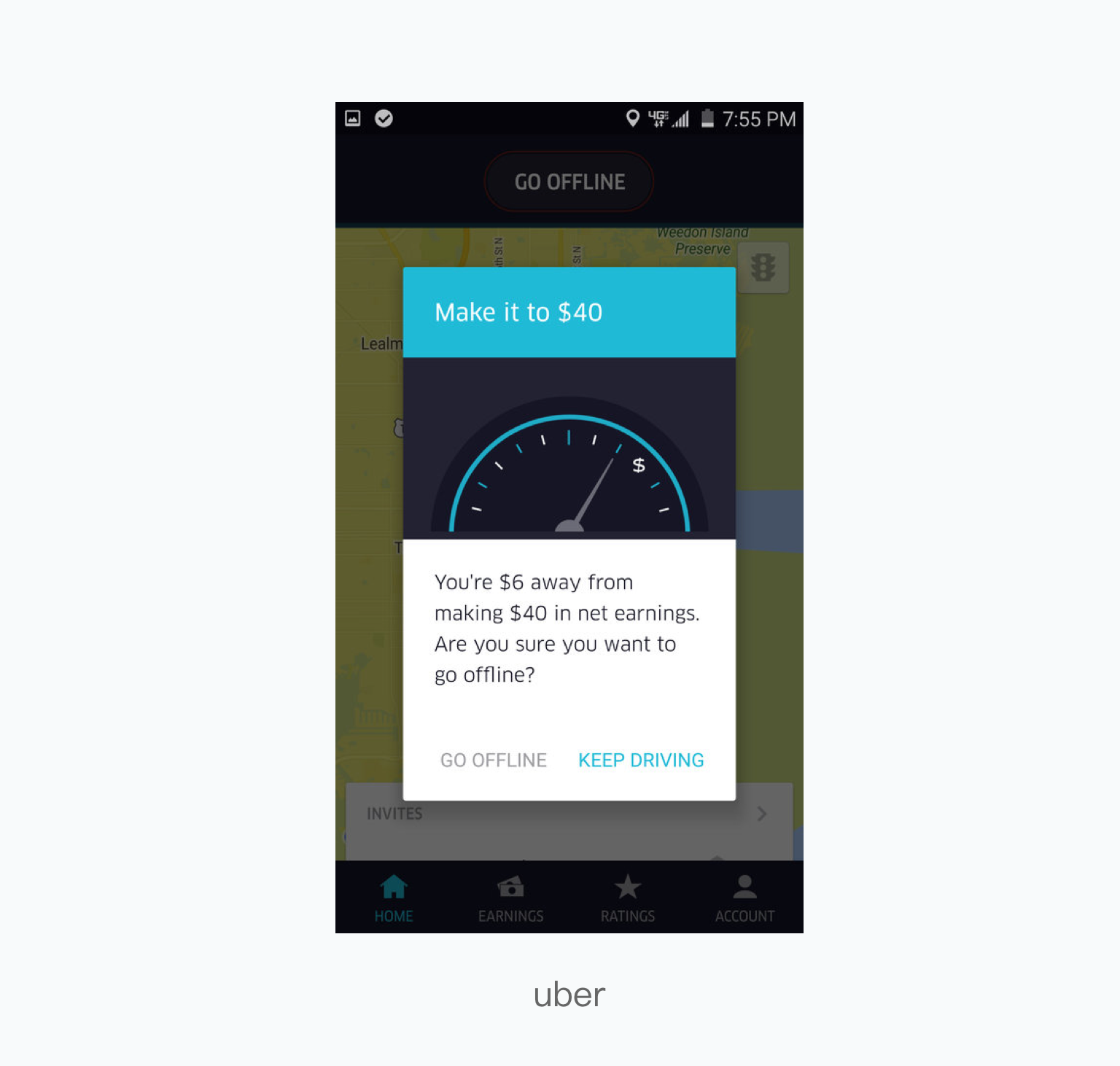
溶液的酸碱性(即 pH 值的高低)根本上取决于溶液中氢离子(H⁺,在水中通常以水合氢离子 H₃O⁺ 的形式存在)或氢氧根离子(OH⁻)的浓度。
1. 酸的性质:
- 酸是能够在水中释放氢离子(H⁺)的物质。氢离子的浓度越高,溶液的酸性越强,pH 越低(pH 值小于 7)。
- 常见的酸如盐酸(HCl)、硫酸(H₂SO₄)等,它们在水中解离时会释放出氢离子:
HCl→H++Cl−
2. 碱的性质:
- 碱是能够接受氢离子或者释放氢氧根离子(OH⁻)的物质。氢氧根离子的浓度越高,溶液的碱性越强,pH 越高(pH 值大于 7)。
- 常见的碱如氢氧化钠(NaOH)、氢氧化钙(Ca(OH)₂)等,它们在水中解离时会释放出氢氧根离子:
NaOH→Na++OH−
3. 水的自离子化:
- 水本身也会有一定的酸碱性质,称为水的自离子化:
2H2O⇌H3O++OH−
- 在纯水中,氢离子浓度和氢氧根离子浓度是相等的,各自的浓度为 10−7 mol/L,因此水的 pH 值为 7,处于中性。
4. 酸碱平衡:
- 在水溶液中,酸和碱的浓度总是通过酸碱平衡相互作用。例如,酸释放氢离子,而碱则吸收氢离子(或释放氢氧根离子)。溶液的酸碱性就取决于这两者的平衡:
酸⟶H++阴离子
碱+H+⟶水+阴离子
5. 影响酸碱性的其他因素:
- 盐的影响:某些盐(例如含氯离子、硝酸根离子等)在水中解离后,可能对溶液的 pH 没有太大影响,溶液会保持中性。而某些盐(如氯化铵 NH₄Cl)则会影响 pH,因为它们可能会产生酸性或碱性反应。
总之,溶液的酸碱性由溶液中氢离子浓度([H⁺])或氢氧根离子浓度([OH⁻])决定。如果氢离子浓度较高,溶液呈酸性;如果氢氧根离子浓度较高,溶液呈碱性。