大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
R-loop(RNA-DNA杂合结构)是转录调控、DNA复制和修复等关键细胞过程的重要组成部分。但R-loop异常积累可能会破坏基因组完整性,从而导致多种疾病的发生。越来越多证据强调了RNA甲基化修饰(尤其是m6A和m5C)在调控R-loop形成、分解和稳定中发挥的关键作用。这些修饰动态调控R-loop的代谢过程,在基因表达调控和DNA损伤修复过程中通过促进或分解R-loop结构来实现双向调控。RNA甲基化失调以及由此导致的R-loop稳态失衡与癌症和神经退行性疾病等疾病的发病机制密切相关。因此,解码RNA甲基化与R-loop之间的交叉调控对于理解基因组稳定性背后的机制以及鉴定新的治疗靶点至关重要。本文全面分析了RNA甲基化在R-loop动态变化中的作用,探讨了其生理和病理学意义,并提出了靶向这些过程的未来治疗干预方向。
R-loop在细胞生理学和病理学中的生物学意义
R-loop是由新生RNA(nascent RNA)与DNA模板链形成的RNA-DNA杂合结构,这种结构在正常生理条件下广泛存在于高转录基因中,参与多种关键生物过程,如基因表达调控、DNA复制、DNA损伤修复等。
R-loop的形成和分解受到严格调控,其动态平衡对维持基因组稳定性至关重要。然而,当这种平衡被打破时,R-loop的异常积累会导致基因组不稳定,进而引发多种疾病。
RNA甲基化修饰的作用
RNA甲基化修饰(如m6A、m5C等)在RNA代谢的多个方面发挥关键作用,包括剪切、翻译、稳定性、定位和二级结构。近年来,研究发现RNA甲基化修饰在R-loop的形成、稳定和分解中起着核心作用,通过动态调节R-loop代谢影响基因组完整性和DNA损伤修复。
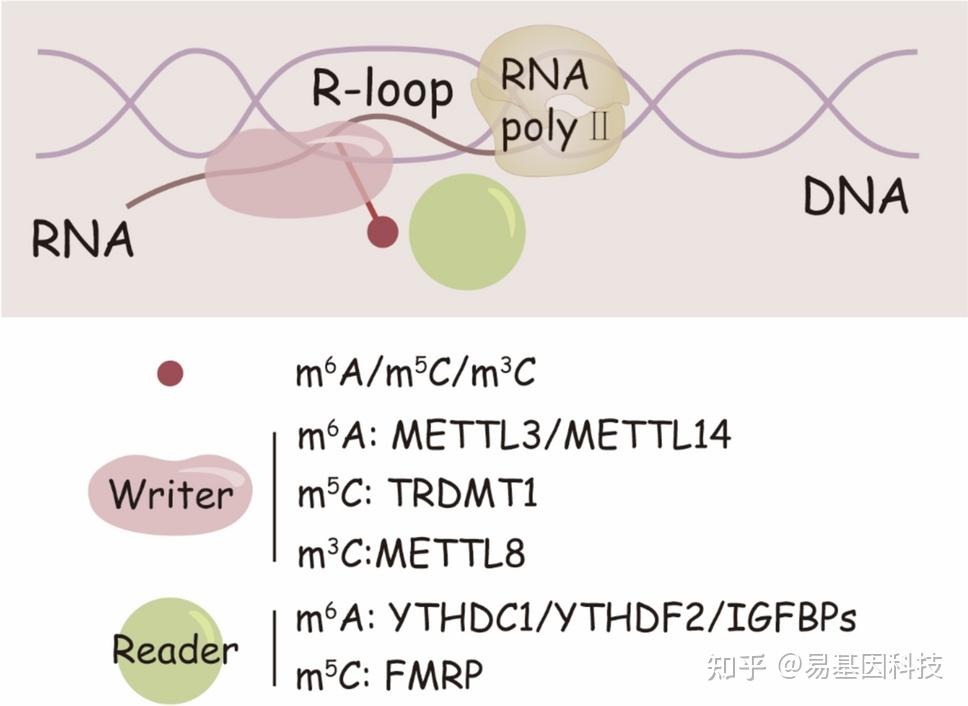
图1:关键的RNA甲基化“writer”和“reader”调控R-loop形成和稳定性。RNA甲基化类型,如m6A、m5C和m3C,在调控R-loop代谢中发挥关键作用。甲基转移酶METTL3和METTL14介导m6A修饰,而TRDMT1和METTL8分别介导m5C和m3C修饰。这些“writers”与YTHDC1、YTHDF2和FMRP等“readers”蛋白协作,后者能够识别甲基化RNA并帮助分解或稳定R-loop。这种调控的破坏可能导致R-loop异常积累,进而引发基因组不稳定性。
RNA 甲基化在调控R-loop稳定性中的作用
(1)m6A 甲基化在 R-loop中的双重作用
m6A是最常见的可逆RNA甲基化修饰,主要由METTL3、METTL14和WTAP复合体催化。m6A修饰在R-loop的形成和稳定中发挥重要作用。如METTL3在转录终止位点附近添加m6A修饰,促进R-loop的形成;同时,m6A修饰通过与YTHDC1等“reader”蛋白结合,防止R-loop的降解,维持其稳定性。
m6A修饰还参与R-loop的解离,通过招募RNase H1等酶来分解RNA-DNA杂合结构,从而维持R-loop动态平衡。
(2)m5C 和 m3C甲基化在R-loop中调控作用
m5C修饰通过TRDMT1介导,能够稳定R-loop形成,特别是在富含G的区域。FMRP是一种m5C的“reader”蛋白,它通过与TET1(m5C去甲基化酶)相互作用,促进R-loop的解离。
m3C修饰由METTL8催化,其SUMO化修饰后活性增强,促进R-loop积累,但也可能通过不同异构体与其他RNA结合蛋白合作来调节R-loop的解离。
R-loop和RNA甲基化在DNA损伤修复中的作用
(1)R-loop积累诱导的基因组不稳定性和甲基化的调控作用
R-loop的异常积累可能导致转录-复制冲突(TRC),引发DNA双链断裂(DSB)和基因组不稳定。RNA甲基化修饰通过调节R-loop的形成和解离,维持基因组稳定性。例如,METTL3介导的m6A修饰不足会导致R-loop积累,增加DNA损伤风险。
总结而言,R-loop的过度积累是导致基因组不稳定性和DNA损伤的关键因素。RNA甲基化通过调节R-loop的动态平衡,在维持基因组稳定性中发挥核心作用。无论是m6A还是m3C修饰失调,都可能导致R-loop积累增加,显著提高DNA损伤的风险。这突显了甲基化在调控R-loop中的关键作用及其对基因组完整性的深远影响。
当RNA甲基化的“writer”和“reader”(如m6A“writer”METTL3/METTL14和m6A“reader”YTHDC1)发生失调时,R-loop的形成和解离会受到损害。这会导致R-loop积累增加,进而引发转录-复制冲突(TRCs)和DNA双链断裂(DSBs),两者均会加剧基因组的不稳定性。这种基因组不稳定性是包括癌症和神经性疾病在内的多种疾病发生的关键因素。
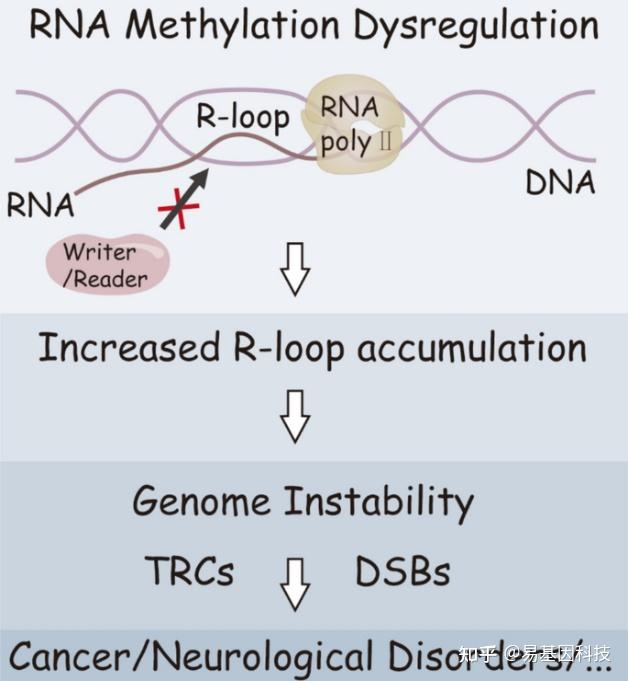
图2:RNA甲基化失调促进R-loop积累和基因组不稳定性。
(2)R-loop和RNA甲基化在DNA损伤修复中的调控作用
DNA 损伤后,特别是在 DSB 期间,复杂的修复机制被激活,R-loop的形成和解离在此过程中起着至关重要的调节作用。RNA甲基化,尤其是m6A和m5C修饰,通过调节R-loop的动态平衡,显着影响修复过程的进展和效率。
R-loop的解离不仅依赖于RNA甲基化,还依赖于特定酶的作用。甲基化修饰通过协助招募RNase H1(一种负责解离R-loop的关键酶)来发挥作用。通过防止R-loop的过度积累,RNase H1确保了DNA末端切除的正常进行以及同源重组修复的顺利开展。例如,ARID1A能够招募METTL3对R-loop进行m6A甲基化修饰,从而促进RNase H1的结合并加速R-loop解离,这对于高效的DNA修复至关重要。
总结而言,RNA甲基化通过调控R-loop的形成、积累和解离,在DNA损伤修复中发挥核心作用。通过促进R-loop的解离和招募修复蛋白,甲基化确保了DNA损伤修复的及时性和高效性。这些甲基化通路中的突变或功能障碍可能会损害正常的R-loop解离,最终威胁基因组稳定性。
(3)甲基化和R-loop对DNA损伤修复通路选择的影响
在DNA损伤修复过程中,R-loop的形成和解离对同源重组(HR)和非同源末端连接(NHEJ)等修复通路选择至关重要。m6A和m5C修饰通过调节R-loop的动态平衡,影响修复蛋白(如RAD51、BRCA1)的招募,从而决定修复通路的选择。例如,TRDMT1介导的m5C修饰促进HR修复,而其缺失则导致NHEJ修复增强。
总之,RNA甲基化通过调节R-loop动态变化和修复蛋白的招募,影响DNA损伤修复通路选择。异常甲基化修饰不仅破坏R-loop稳态,还会导致修复通路选择不当,最终影响基因组稳定性。
在DNA双链断裂(DSBs)下,R-loop可能在断裂位点形成,从而影响修复通路选择。m6A和m5C修饰可以通过招募RAD51/RAD52等修复蛋白来促进同源重组(HR)修复。相比之下,未能有效解离R-loop可能导致替代性非同源末端连接(Alt-NHEJ)通路激活,这一过程由PARP1及其相关蛋白介导。
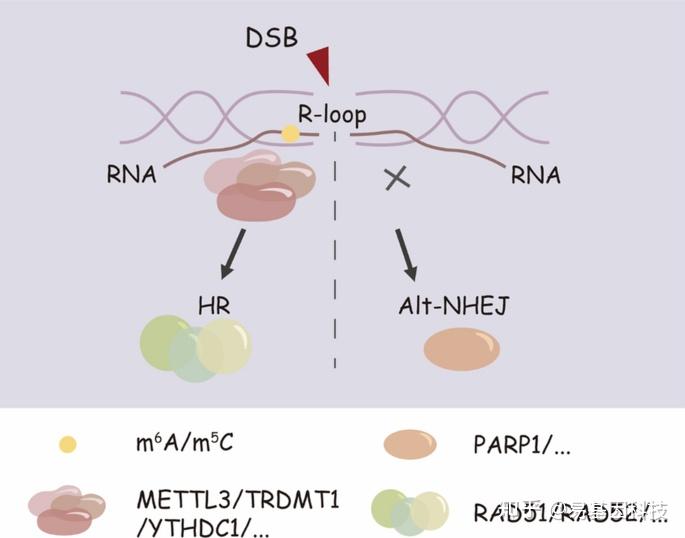
图3:R-loop的调控影响DNA损伤修复过程中HR和Alt-NHEJ通路选择。
R-loop和RNA甲基化在疾病中的作用
RNA甲基化和R-loop失调与多种疾病有关,包括癌症、神经系统疾病和血液病。这些机制通过影响基因组稳定性和DNA修复在疾病进展中发挥关键作用(表1)。
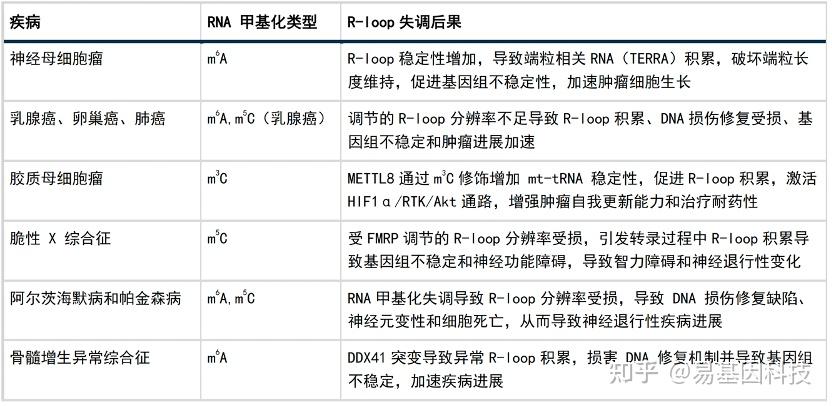
表1:RNA甲基化和R-loop失调相关疾病概述
(1)癌症中的R-loop和RNA甲基化
R-loop的异常积累和RNA甲基化的失调在多种肿瘤的发生、发展和治疗响应中发挥关键作用。RNA甲基化通过调节R-loop的形成、解离和稳定性,直接影响肿瘤的起始、进展和对治疗的反应。例如,METTL3通过m6A修饰调节TERRA R-loop的稳定性,影响端粒维持和肿瘤细胞增殖。在神经胶质瘤中,METTL8通过m3C修饰激活HIF1α/RTK/Akt通路,促进肿瘤的侵袭性和治疗抵抗性。
此外,与甲基化相关的“reader”蛋白在肿瘤抑制中也发挥关键作用。例如,IGF2BPs通过识别m6A修饰的R-loop,在前列腺癌中抑制肿瘤细胞的增殖和迁移,发挥肿瘤抑制作用。这一机制涉及阻断DNA甲基转移酶DNMT1与启动子区域的相互作用,防止异常的DNA甲基化,从而抑制异常细胞增殖。类似地,FMRP功能失调会导致乳腺癌中R-loop的异常积累,进一步破坏转录和DNA修复,推动肿瘤的起始和进展。在胶质母细胞瘤中,m6A修饰与YTHDC1相互作用,调节circPOLR2B及其母基因POLR2B中的R-loop形成,通过下游调控PBX1基因增强肿瘤细胞的自我更新和侵袭性。
总结而言,m6A、m5C和m3C修饰的失调通过影响R-loop的形成和解离,促进肿瘤细胞的增殖、侵袭性和耐药性,突显了RNA甲基化和R-loop在肿瘤发展和进展中的核心作用。
(2)其他疾病中的R-loop和RNA甲基化
除了在肿瘤中起关键作用外,R-loop和RNA甲基化的失调在其他疾病中也起着关键作用,尤其是血液学疾病和神经系统疾病。在阿尔茨海默病和帕金森病中,RNA甲基化修饰失调导致R-loop解离受损,DNA损伤修复缺陷,进而引发神经退行性变化。在骨髓增生异常综合征(MDS)中,DDX41突变导致R-loop积累,损害DNA修复机制,加速疾病进展。
总之,RNA甲基化通过调节R-loop的形成和解离,广泛影响基因组稳定性和DNA修复能力。无论是血液系统疾病(如MDS)还是神经系统疾病(如阿尔茨海默病和脆性X综合征),R-loop和RNA甲基化失调均会导致基因组不稳定和DNA损伤修复受损,从而进一步推动疾病进展。深入理解这些机制将有助于未来开发靶向RNA甲基化和R-loop调控的新型治疗策略。
未来的研究方向和治疗靶点
未来研究方向
- 开发更精确的R-loop检测工具,如R-ChIP技术,以提高对R-loop动态的解析能力。
- 探索其他RNA修饰(如m1A、Ψ)在R-loop调控中的作用,以及它们与m6A和m5C的协同作用。
- 研究不同细胞类型(如神经元、干细胞、癌细胞)中R-loop和RNA甲基化的调控机制差异。
潜在治疗靶点
- 靶向RNA甲基化修饰的药物开发,如METTL3抑制剂,可能通过破坏R-loop稳定性来治疗癌症。
- 结合RNA降解策略和甲基化修饰调节剂,开发靶向R-loop降解的特异性核酸酶系统。
- 靶向RNA和DNA甲基化修饰的联合干预,可能为肿瘤和遗传性疾病的治疗提供新的策略。
易小结
本文深入探讨了RNA甲基化修饰与R-loop之间的交叉调控机制,并强调了这种调控在基因组稳定性、DNA损伤修复和疾病发生中的关键作用。通过揭示这些机制为未来的研究和治疗策略提供了重要的理论基础和潜在方向。
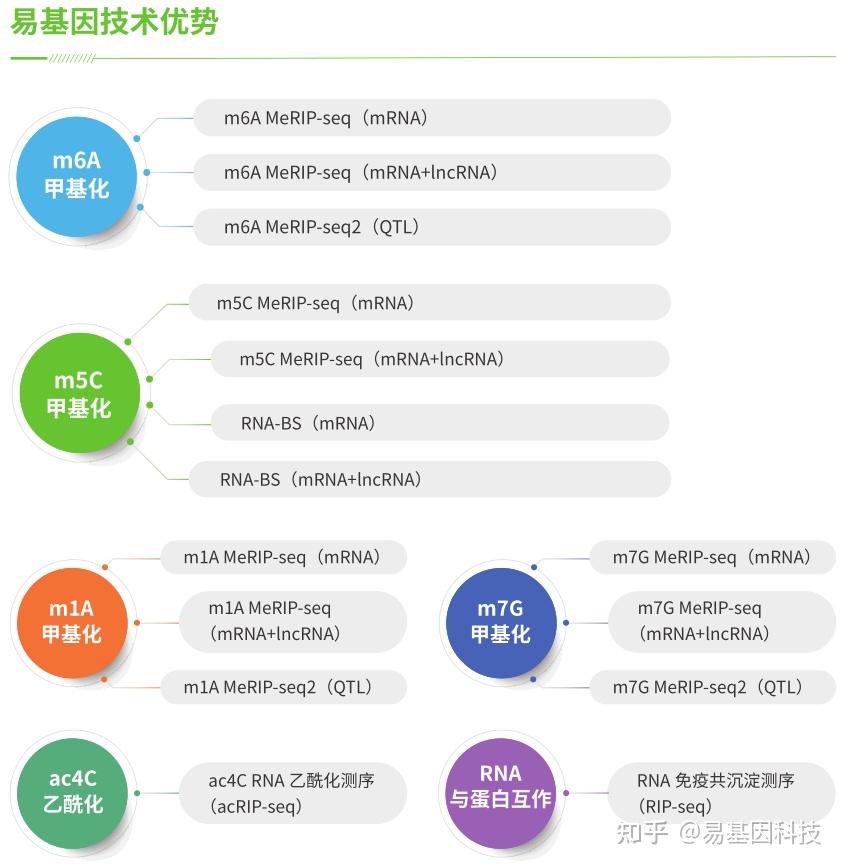
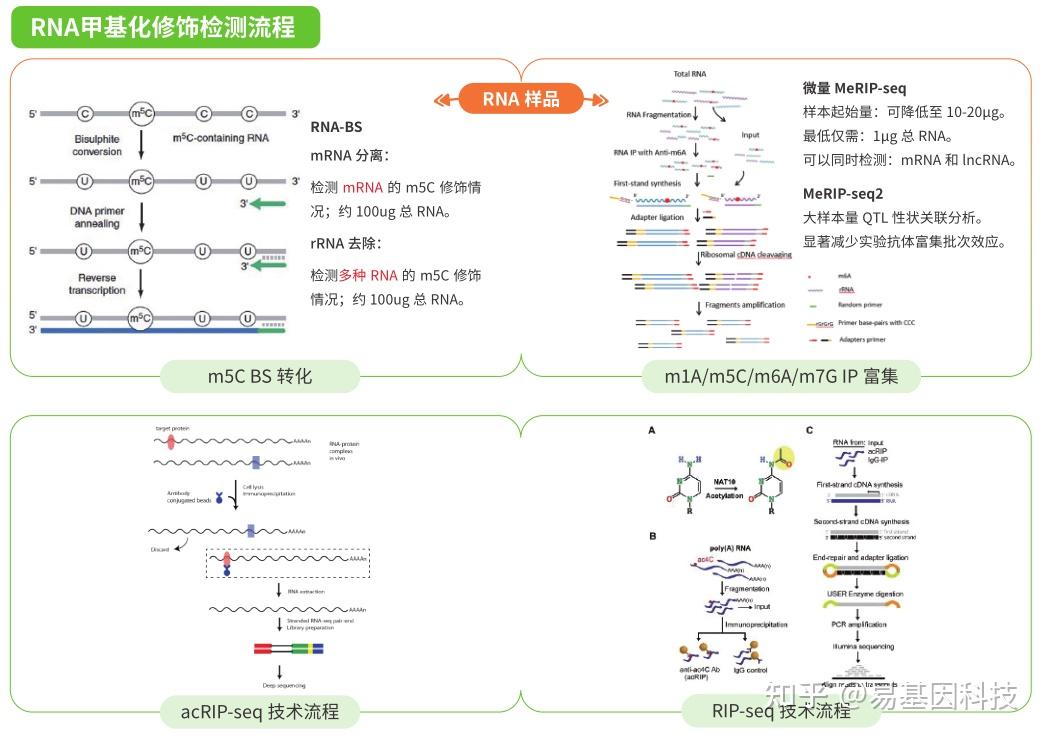
易基因RNA甲基化修饰整体研究方案
易基因特异性R-loop检测整体研究方案
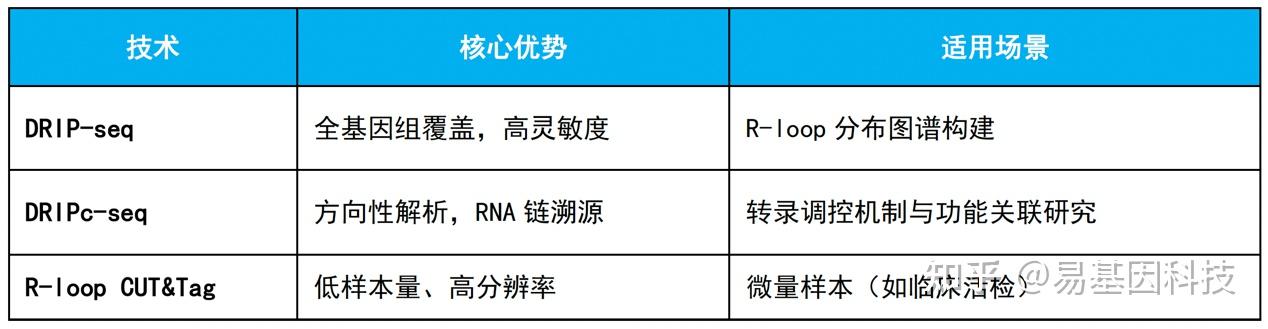
- DRIP-seq(DNA:RNA Hybrid Immunoprecipitation Sequencing):基于S9.6抗体特异性识别RNA:DNA 杂交链,通过免疫沉淀富集R-loop区域,结合NGS测序实现全基因组覆盖。
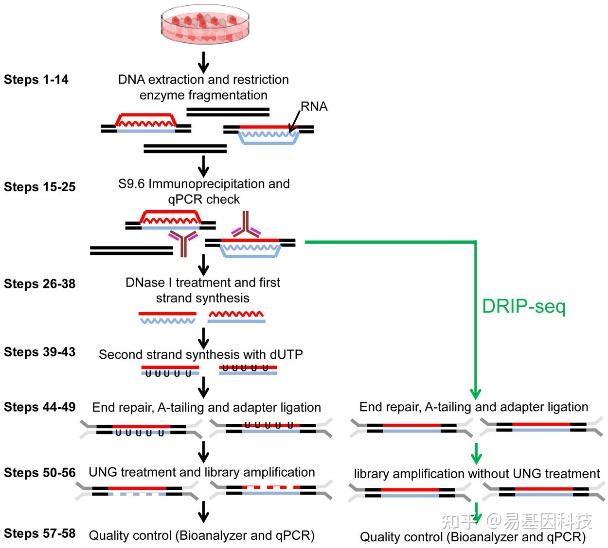
优势:
✅ 高特异性:S9.6抗体精准捕获DNA:RNA 杂交体,避免假阳性。
✅ 高灵敏度:高灵敏度定位全基因组R-loop分布。
✅ 无酶干扰:不依赖内切酶消化,保留天然R-loop结构。
✅ 广泛兼容性:适用于细胞、组织、血液、植物等多种样本类型。
- DRIPc-seq(DRIP with cDNA Sequencing):在DRIP-seq基础上,对免疫沉淀的RNA链进行cDNA建库,明确R-loop中RNA来源链及转录方向。
- R-loop CUT&Tag:利用S9.6抗体引导Tn5转座酶靶向切割R-loop区域,直接在DNA片段两端添加测序接头,无需免疫沉淀步骤。
参考文献:
Wu Y, Lin S, Chen H, Zheng X. Cross-regulation of RNA methylation modifications and R-loops: from molecular mechanisms to clinical implications. Cell Mol Life Sci. 2024 Dec 10;82(1):1. pii: 10.1007/s00018-024-05536-1. doi: 10.1007/s00018-024-05536-1.
相关阅读:
1、2024项目文章精选:DNA甲基化、RNA甲基化(m6A/m5C)、ChIP-seq、单细胞转录组、宏基因组|年终盘点
2、项目文章 | Adv Sci:NSUN2介导m5C修饰代谢重编程促进肿瘤进展 揭示治疗新选择
3、项目文章 | NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
4、项目文章:MeRIP-seq+RNA-seq揭示不同品种猪肌肉发育的m6A RNA甲基化差异|育种研究
5、项目文章:MeRIP-seq+RNA-seq揭示家禽(鸡)脂肪沉积中的m6A RNA甲基化调控机制
6、项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
7、项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
8、项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
9、一文读懂:八大RNA m⁶A甲基化研究核心问题
10、m6A/m5C/m1A/m7G/ac4C/Ψ等8种RNA修饰的生物学功能和潜在机制 | 深度综述
11、深度综述:癌症中RNA修饰机制的遗传和表观遗传失调(m6A+m1A+m5C+ψ)
12、技术推介|RNA m5C甲基化测序(RNA-BS)
13、技术推介|ac4C乙酰化RNA免疫沉淀测序(acRIP-seq)
14、技术推介|RNA m7G甲基化测序(m7G-MeRIP-seq)
15、技术推介|m1A RNA甲基化测序(MeRIP-seq/m1A-seq)
16、技术推介|RNA m⁶A甲基化测序(MeRIP-seq)技术介绍