大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
食管胃结合部腺癌(adenocarcinoma of the esophagogastric junction,AEG)是一种在食管胃结合部发生的腺癌,其发病率在全球范围内呈上升趋势,但具体的发病机制尚不明确。尽管在基因组、转录组、蛋白质组和磷酸化蛋白质组水平上对大量AEG患者进行了深入研究,但AEG仍然缺乏有效的治疗靶点和预后标志物。因此,理解AEG癌变的分子机制并识别潜在的预后标志物和治疗靶点是至关重要的。N6-甲基腺苷(m6A)修饰及其调控因子在人类癌症中发挥着关键作用,但它们在食管胃结合部腺癌(AEG)中的功能和调控机制仍不清楚。
2024年08月06日,广东省人民医院(广东省医学科学院)普外科李勇教授研究团队和东南大学附属中大医院高山教授研究团队合作在《Int J Biol Sci》杂志发表题为“m6A modification enhances the stability of CDC25A promotes tumorigenicity of esophagogastric junction adenocarcinoma via cell cycle“的研究论文,研究纳入30名新诊断的AEG患者,收集其手术后的新鲜样本后通过RNA-seq、RIP/meRIP-seq、 LACE-seq等分析揭示了m6A修饰增强CDC25A稳定性,进而通过细胞周期促进食管胃结合部腺癌(AEG)的致瘤性。

标题:m6A modification enhances the stability of CDC25A promotes tumorigenicity of esophagogastric junction adenocarcinoma via cell cycle(m6A修饰增强CDC25A稳定性,进而通过细胞周期促进AEG致瘤性)
期刊:International Journal of Biological Sciences(Int J Biol Sci)
影响因子:IF 8.2
技术平台:RNA-seq、RIP/meRIP-seq(易基因优势技术)、 LACE-seq等
本研究从大量AEG患者的m6A调控因子表达谱中发现,与配对的正常邻近组织相比,IGF2BP3是AEG肿瘤中蛋白表达上调最显著的m6A调控因子。沉默IGF2BP3可以在在体外和体内抑制AEG进展。通过对AEG中IGF2BP3的全转录组靶标和m6A甲基化组分析结果表明,IGF2BP3介导的m6A修饰靶点的稳定性和表达增强,包括细胞周期通路靶点,如CDC25A、CDK4和E2F1,对AEG进展至关重要。从机制上讲,CDC25A的m6A修饰增加加速了G1-S期的转换。临床上IGF2BP3、METTL3和CDC25A在TCGA泛癌细胞(包括AEG)中的表达上调表现出强正相关。总之,本研究强调了转录后调控在调控AEG肿瘤进展中的作用,并阐明了m6A/IGF2BP3/CDC25A轴在AEG细胞中的功能重要性。
研究方法:
- 纳入30名新诊断AEG患者,收集了手术后的新鲜样本。
- 使用人AEG细胞系进行细胞培养,并进行质粒转染。
- qRT-PCR、免疫印迹等方法分析基因和蛋白表达。
- 细胞增殖、迁移、集落形成实验、荧光素酶报告基因检测等功能性实验。
- RNA-seq、RIP/meRIP-seq、LACE-seq等测序分析。
- 裸鼠模型的体内实验评估IGF2BP3 KD或CDC25A过表达对肿瘤形成和生长的影响。
结果图形
(1)IGF2BP3表达上调与AEG患者预后不良相关
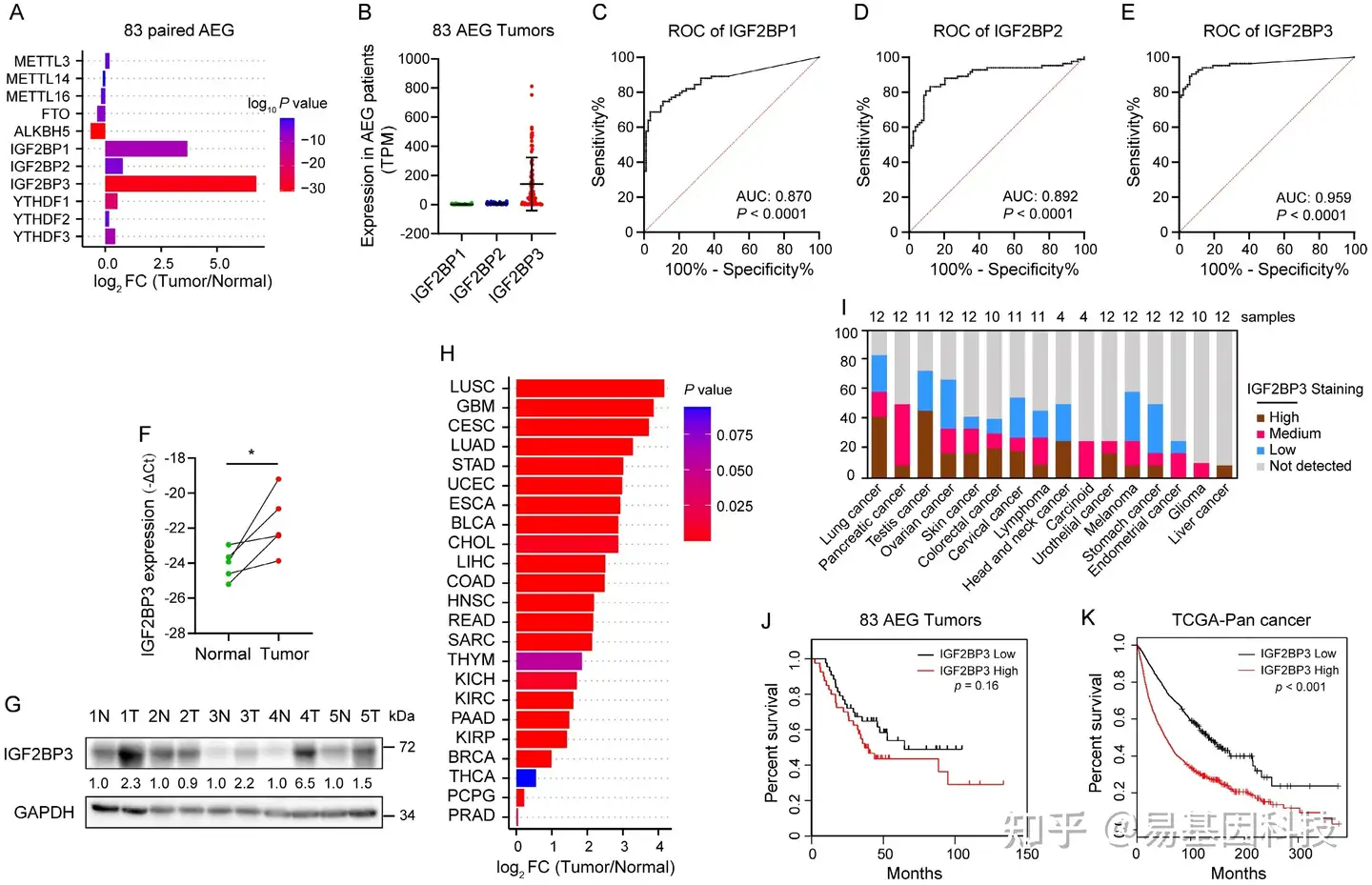
图1:IGF2BP3表达上调与AEG患者预后不良相关。
(A-B) 83个AEG肿瘤相对于邻近正常组织(m6A调节因子(A)和IGF2BPs(B)的差异表达分析(PRJNA788008))。
(C-E) 83名AEG患者IGF2BPs的ROC分析(C-D)。
(F-G) 5对AEG肿瘤(T)及邻近正常组织(N)中IGF2BP3的mRNA和蛋白表达水平(n = 5)。
(H) TCGA数据集中23种癌症类型中IGF2BP3 mRNA水平差异分析。
- HPA数据集中16种癌症类型中IGF2BP3蛋白的表达水平。
(J-K) Kaplan-Meier生存分析显示AEG患者和TCGA泛癌中IGF2BP3 mRNA表达水平低和高的整体生存率。
(2)IGF2BP3在AEG中的致癌作用
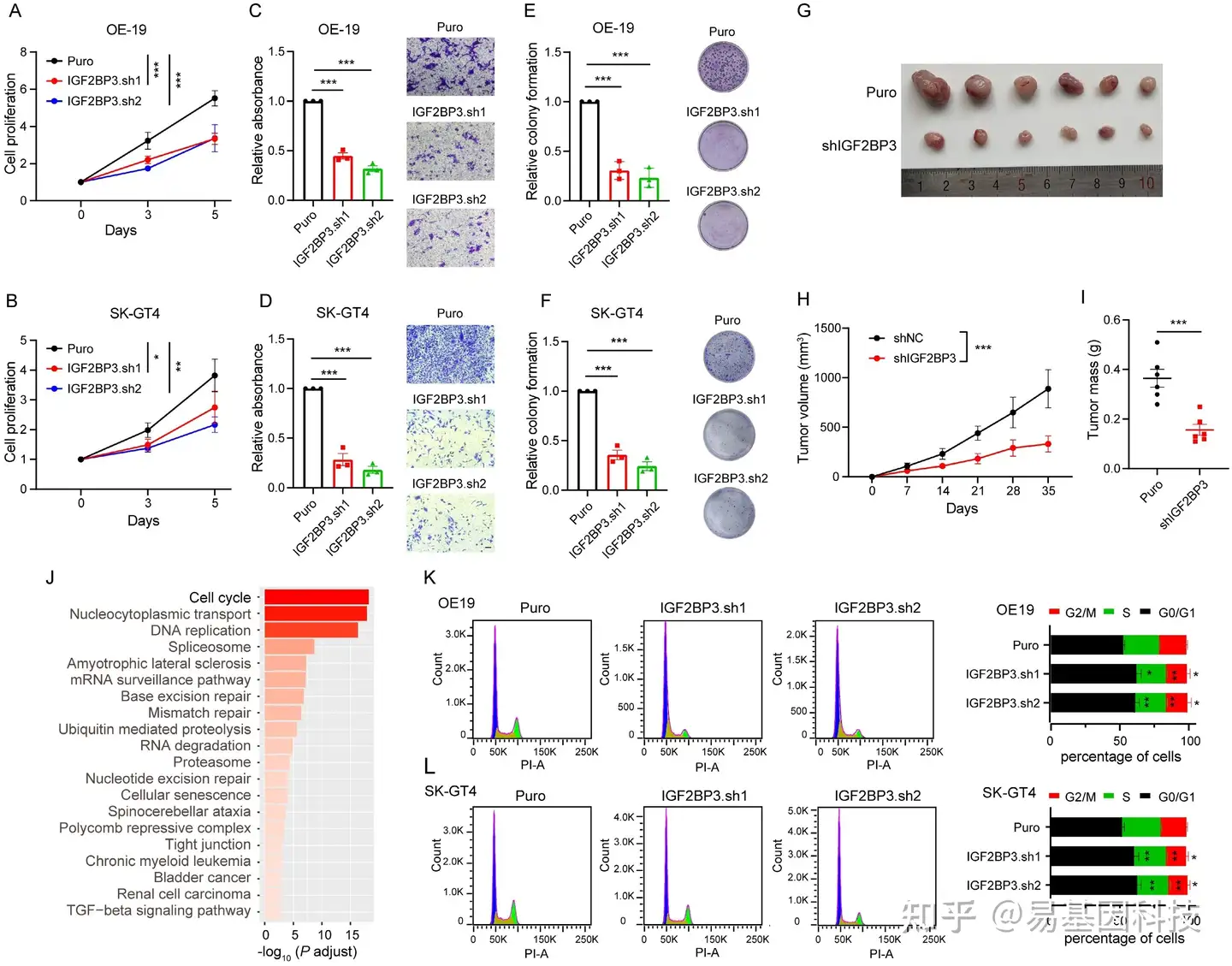
图2:IGF2BP3在AEG中发挥致癌作用。
(A-B) 评估IGF2BP3敲低(KD)OE-19 (A) 和 SK-GT4 (B) 细胞的细胞增殖实验。
(C-D) IGF2BP3-KD OE-19 (C) 和 SK-GT4 (D) 细胞在未涂层Transwell实验中的定量分析(左)和代表性显微照片(右)。
(E-F) IGF2BP3-KD OE-19 (E) 和 SK-GT4 (F) 细胞集落形成实验中的定量分析(左)和代表性图像(右)。
(G-I) IGF2BP3-KD OE-19细胞对裸鼠( n = 6)肿瘤大小(G)、肿瘤生长(H)和质量(I)的影响。
(J) KEGG分析显示IGF2BP3 KD OE-19细胞中下调基因的前20个显著富集通路。
(K-L) 流式细胞术分析显示IGF2BP3-KD OE-19 (K) 和 SK-GT4 (L) 细胞在sub-G0-G1期、S期和G2-M期细胞周期阶段的百分比(n = 3)。显示代表性的细胞周期图谱(左)和定量分析(右)。
(3)IGF2BP3 KD全局下调靶基因表达
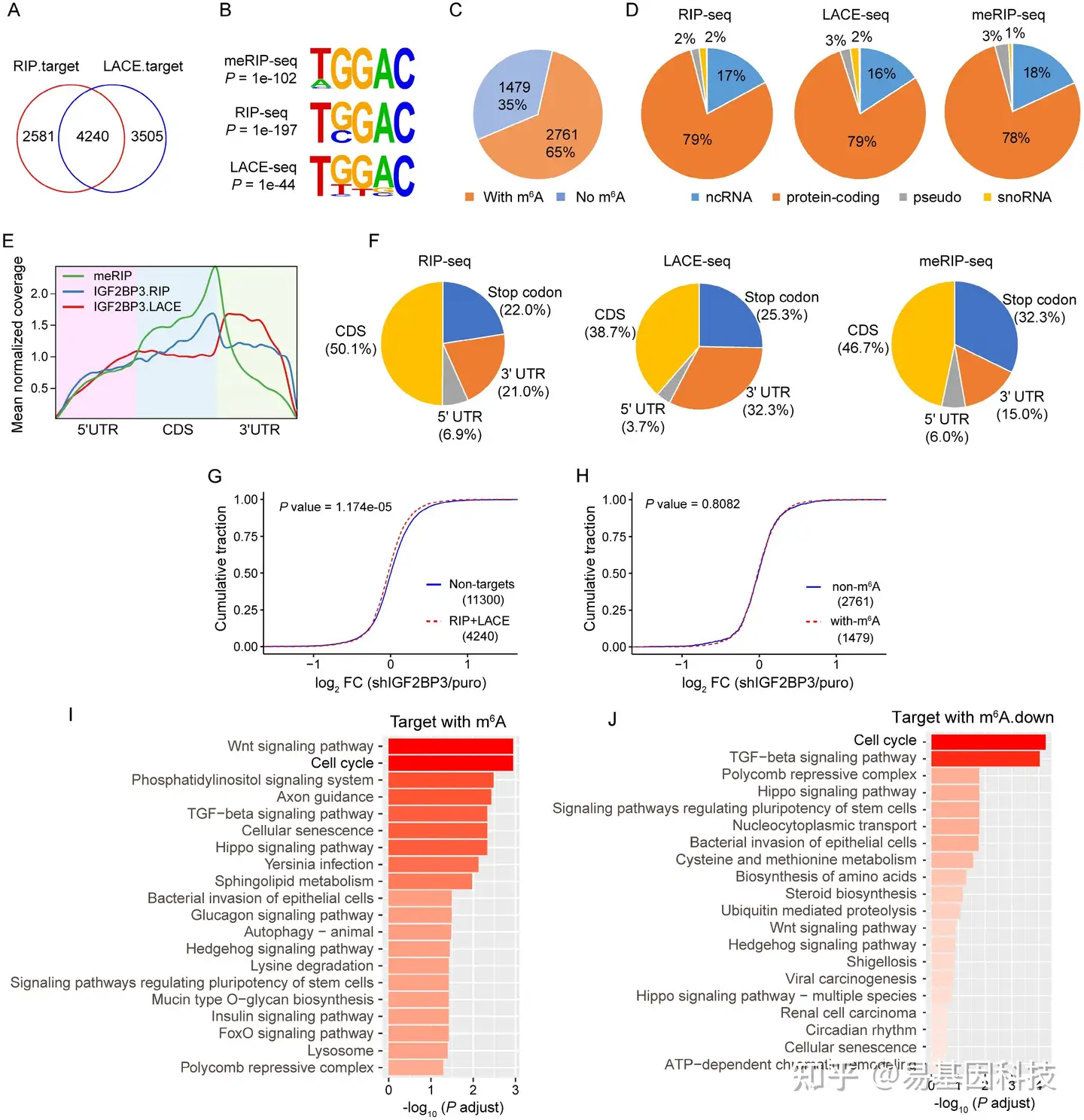
图3:IGF2BP3 KD 全局下调靶基因表达。
- 在OE-19细胞中通过RIP-seq和LACE-seq鉴定IGF2BP3靶基因的重叠。
- 使用meRIP-seq、RIP-seq和LACE-seq数据进行HOMER motif分析检测到的IGF2BP3结合位点和m6A motif的顶部共有序列。
- 饼图显示含有m6A peaks的IGF2BP3高置信度靶基因的数量和百分比。
- RIP-seq、LACE-seq和meRIP-seq中各种RNA类型百分比。
- Metagene分析显示IGF2BP3结合位点和m6A修饰在mRNA转录组中的富集情况。
- 不同基因区域内IGF2BP3结合峰和m6A peaks分布。
(G-H) IGF2BP3 KD后,非靶基因、IGF2BP3高置信度靶基因 (G) 以及带有或不带有m6A的IGF2BP3高置信度靶基因 (H) 的mRNA log2FC的累积频率。
(I-J) KEGG分析显示带有m6A的IGF2BP3高置信度靶基因的前20个显著富集通路 (I) 以及带有m6A的IGF2BP3高置信度靶基因和IGF2BP3 KD中下调基因的重叠基因 (J)。
(4)IGF2BP3以m6A依赖性方式稳定CDC25A转录本

图4:IGF2BP3以m6A依赖性方式稳定CDC25A转录本。
- 在IGF2BP3 KD后,以m6A依赖性方式结合IGF2BP3的细胞周期相关基因的差异表达分析。
- IGF2BP3 KD OE-19和SK-GT4细胞中CDC25A的qRT-PCR分析。
(C-D) IGF2BP3 KD (C) 和IGF2BP3过表达 (OE) (D) OE-19(上图)和SK-GT4(下图)细胞中CDC25A的免疫印迹分析。
(E) METTL3 KD OE-19和SK-GT4细胞中CDC25A的qRT-PCR分析。
(F-G) METTL3 KD (F) 和METTL3 OE (G) OE-19和SK-GT4细胞中CDC25A的免疫印迹分析。
(H-I) 在IGF2BP3 (H) 或METTL3 (I) KD OE-19细胞中,用5μM放线菌素D(actinomycin D)处理指定时间后CDC25A的半衰期。
(5)CDC25A m6A位点鉴定
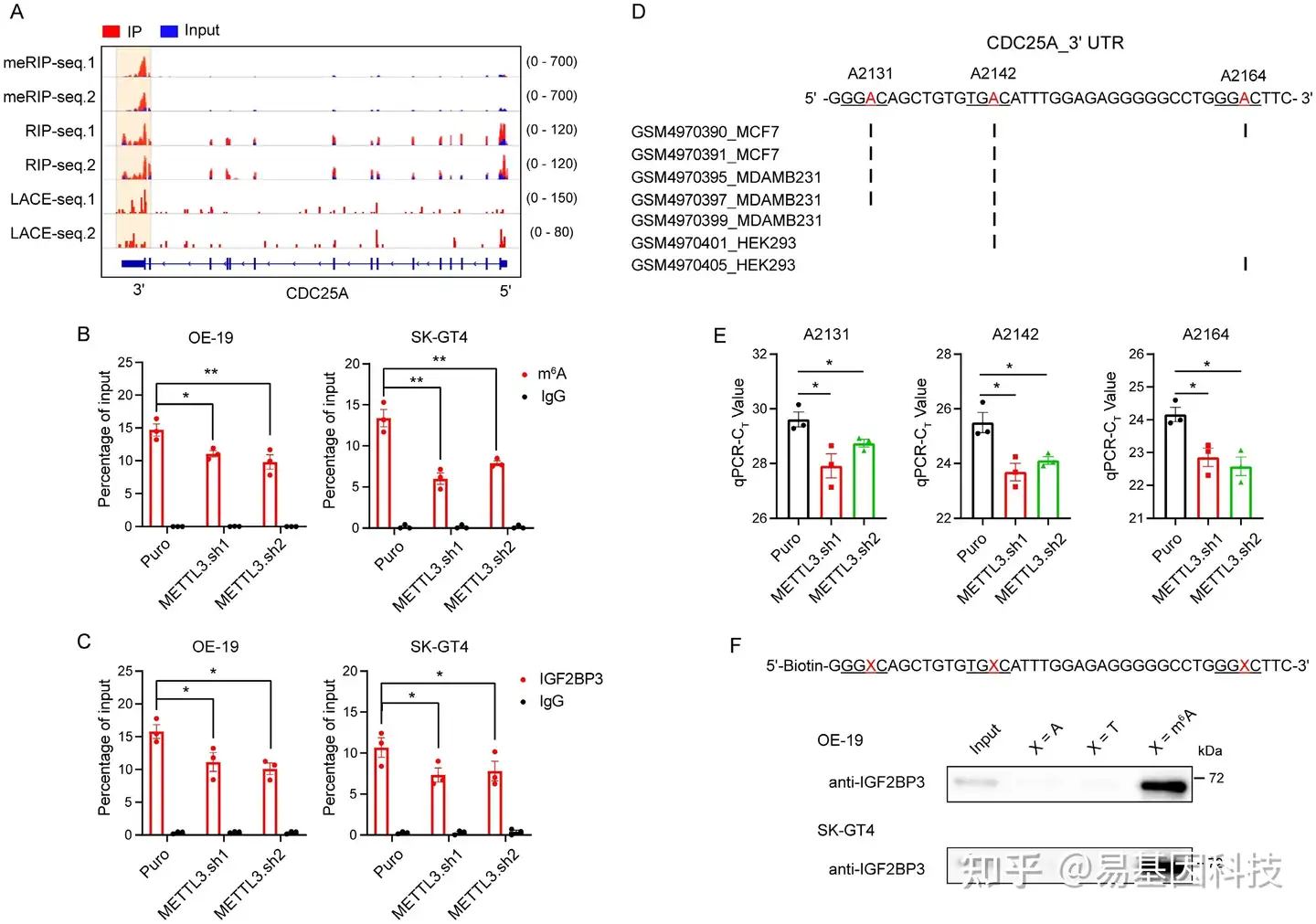
图5:鉴定CDC25A的m6A位点。
- 基于meRIP-seq、IGF2BP3 RIP-seq和LACE-seq数据(n=2)的CDC25A转录本峰值分布。
- m6A RIP-qPCR显示METTL3 KD OE-19(左)和SK-GT4(右)细胞中CDC25A 3' UTR的m6A修饰富集。
- RIP-qPCR显示METTL3 KD OE-19(左)和SK-GT4(右)细胞中CDC25A 3' UTR的IGF2BP3富集。 (D) CLIP-seq数据集揭示CDC25A 3' UTR中的m6A修饰位点。
(E) qPCR的阈值周期(Ct)显示METTL3 KD OE-19细胞中CDC25A的A2131、A2142和A2164位点的SELECT结果。
(F) 有或没有m6A CDC25A 3' UTR探针在OE-19(上图)和SK-GT4(下图)细胞中RNA下拉结果中IGF2BP3富集免疫印迹分析。
(6)IGF2BP3通过其3'UTR中的三个m6A位点增加CDC25A表达
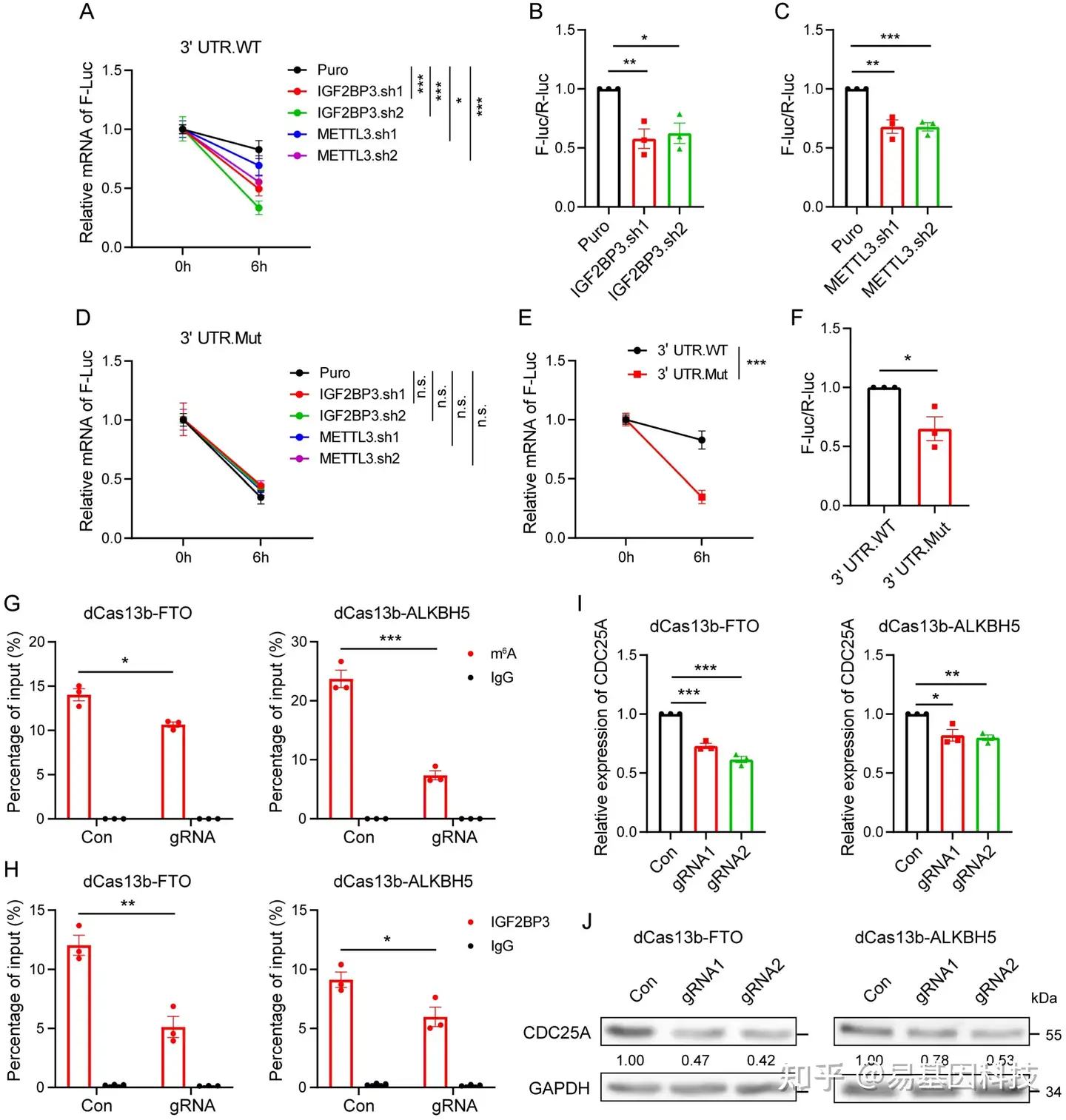
图6:IGF2BP3通过其3' UTR中的三个m6A位点增加CDC25A表达。
(A和D) 在IGF2BP3和METTL3 KD 293T细胞中,用5μM放线菌素D处理指定时间后,耦联3'UTR野生型(A)和突变型(D)F-Luc半衰期。
(B和C) 双荧光素酶检测显示IGF2BP3或METTL3 KD 293T细胞中CDC25A 3' UTR的荧光素酶活性。(E) 293T细胞用5μM放线菌素D处理指定时间后,耦联3'UTR野生型和突变型F-Luc半衰期。
(F) 双荧光素酶检测显示293T细胞中CDC25A 3' UTR野生型和突变型的荧光素酶活性。
(G-H) RIP-qPCR显示转染了FTO和ALKBH5的dm6ACRISPR系统的OE-19细胞中CDC25A 3' UTR的m6A修饰(G)和IGF2BP3(H)的富集。
(I-J) 转染了FTO和ALKBH5的dm6ACRISPR系统的OE-19细胞中CDC25A mRNA(I)和蛋白(J)表达的qRT-PCR和免疫印迹分析。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
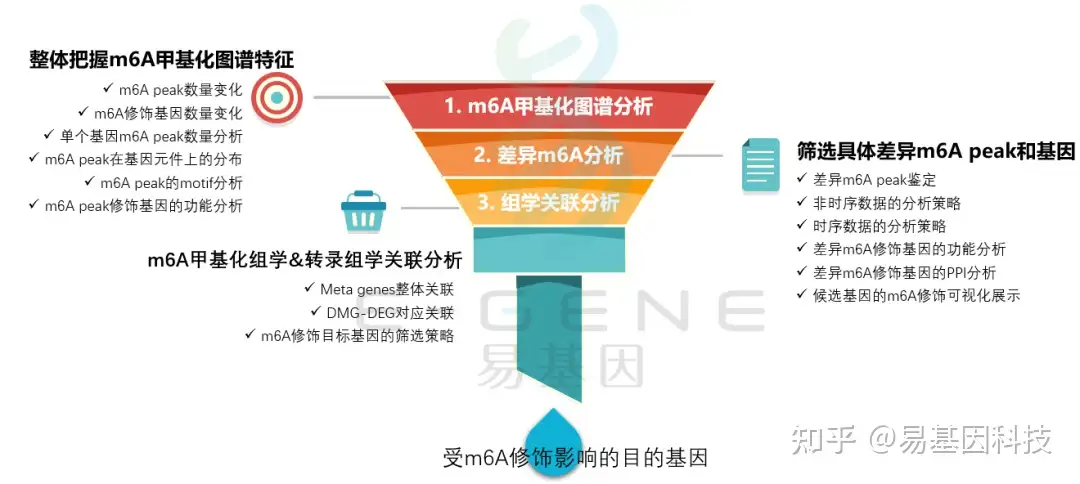
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
参考文献:
Pan Y, Feng H, Zhou J, Zhang W, Liu Y, Zheng J, Wang J, Gao S, Li Y. m6A modification enhances the stability of CDC25A promotes tumorigenicity of esophagogastric junction adenocarcinoma via cell cycle. Int J Biol Sci. 2024;20(11):4209-4221. pii: ijbsv20p4209. doi: 10.7150/ijbs.98535. PubMed PMID: 39247830.
相关阅读:
项目文章:MeRIP-seq+RNA-seq揭示家禽(鸡)脂肪沉积中的m6A RNA甲基化调控机制
项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究