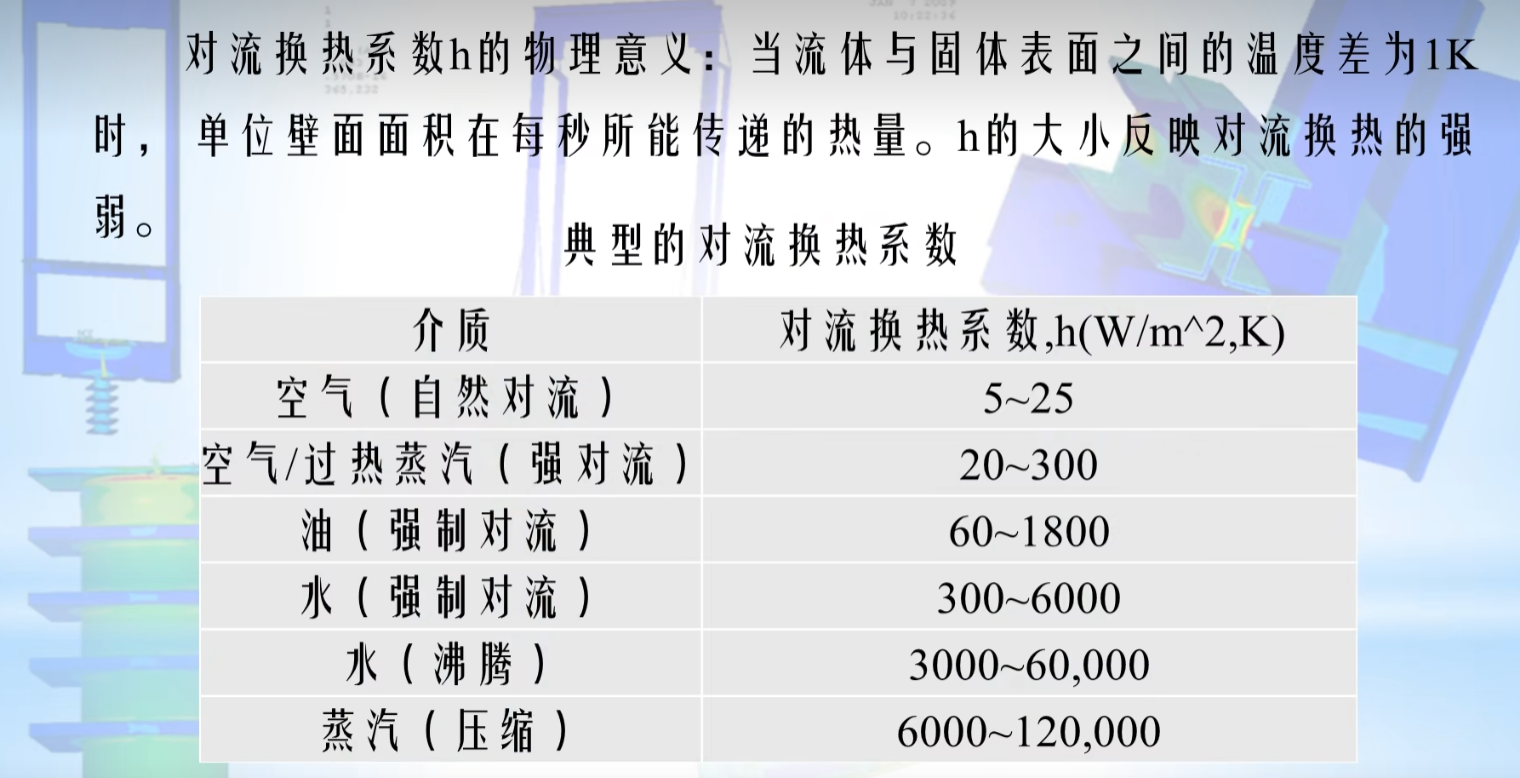
在生命科学与医疗健康领域,抗体技术的革新持续推动着疾病诊疗、药物研发与基础研究的边界拓展。随着精准医疗需求的升级与生物工程技术的突破,抗体开发正朝着高效化、功能化与定制化的方向加速演进。其中,重组抗体制备、阻断抗体开发与山羊抗体定制服务作为兼具前沿性与实用性的技术体系,正通过交叉融合与协同创新,重塑抗体产业的研发范式与应用场景。这些技术不仅为传统医学难题提供了全新解决方案,更在传染病防控、肿瘤免疫治疗与个性化诊断中展现出变革性潜力。
重组抗体制备技术的成熟,标志着抗体生产从依赖动物模型向工程化设计的跨越式转变。与传统杂交瘤技术不同,重组抗体制备通过基因工程手段直接合成抗体序列,并利用哺乳动物细胞、酵母或昆虫细胞等表达系统进行体外生产。这种技术路径的核心优势在于完全可控的抗体结构与功能设计。例如,在CAR-T细胞疗法中,通过重组抗体制备获得的单链抗体(scFv)可精准识别肿瘤细胞表面的CD19或BCMA抗原,其结合亲和力与稳定性均通过理性设计优化,较传统抗体提升数倍。此外,重组技术能够突破物种限制,生产全人源化抗体或跨物种嵌合抗体。在COVID-19大流行中,科学家通过重组抗体制备快速合成了针对新冠病毒刺突蛋白的中和抗体,仅用60天即完成从基因序列到临床级产品的转化,创造了抗体研发的速度纪录。目前,全球超过40%的进入临床阶段的治疗性抗体依赖重组抗体制备技术,其应用场景已从药物开发延伸至诊断试剂、科研工具与工业酶制剂领域。
在抗体功能的精准干预领域,阻断抗体开发正成为靶向治疗的核心策略。阻断抗体通过特异性结合靶分子(如细胞表面受体、炎症因子或病毒蛋白),抑制其生物学活性,从而干预疾病进程。例如,在类风湿性关节炎的治疗中,通过阻断抗体开发设计的抗TNF-α抗体(如阿达木单抗)可有效中和炎症因子,使超过70%的患者实现症状缓解。这类抗体的设计需兼顾表位特异性与作用持久性:利用冷冻电镜解析靶点三维结构,结合分子动力学模拟筛选最佳结合位点,再通过重组抗体制备技术进行亲和力成熟与Fc区改造(如YTE突变延长半衰期)。在肿瘤免疫治疗中,阻断抗体开发与重组抗体制备的结合更为紧密——针对PD-1/PD-L1通路的阻断抗体通过重组技术实现人源化与糖基化优化,其临床疗效较早期鼠源抗体显著提升。值得注意的是,阻断抗体的开发正从单一靶点向多靶点协同演进:例如,同时靶向CTLA-4与LAG-3的抗体组合可通过双重解除免疫抑制,激活T细胞对肿瘤的杀伤能力,这一策略在黑色素瘤治疗中已进入III期临床试验。
作为大型哺乳动物抗体模型的代表,山羊抗体定制服务在规模化生产与特殊应用场景中展现出不可替代的价值。山羊的免疫系统能够产生高滴度、高亲和力的多克隆抗体,其抗体库的多样性尤其适用于针对复杂抗原(如全病毒颗粒或多结构域蛋白)的开发。例如,在狂犬病疫苗效价检测中,通过山羊抗体定制服务制备的抗狂犬病毒多克隆抗体已成为世界卫生组织(WHO)推荐的标准化试剂,其批间一致性达到95%以上。在单克隆抗体领域,山羊模型同样表现卓越:其抗体轻链的基因复杂度较低,使得杂交瘤筛选成功率显著高于其他物种。在神经退行性疾病研究中,科学家利用山羊抗体定制服务开发出靶向tau蛋白的单克隆抗体,该抗体能够有效穿透血脑屏障并促进病理性蛋白聚集体的清除,为阿尔茨海默病的治疗提供了新思路。然而,传统山羊抗体生产周期较长(通常需8-12个月),而通过整合重组抗体制备技术,部分企业已实现抗体基因的体外重组与快速表达,将开发周期压缩至3个月内。
技术的交叉融合正在催生突破性应用。以重组抗体制备为例,其与CRISPR基因编辑技术的结合,使得科学家能够在哺乳动物细胞中定向敲入抗体基因,构建稳定表达特定抗体的工程化细胞系,为连续化生产奠定基础。而阻断抗体开发则与人工智能深度结合:通过训练深度学习模型预测抗体的表位结合模式与脱靶风险,研究者可预先筛选出最佳候选分子,将传统试错性实验减少80%以上。对于山羊抗体定制服务,微流控技术的引入实现了单B细胞的高通量分选与抗体基因捕获,使得单克隆抗体的筛选效率提升数十倍。例如,某公司开发的“芯片上免疫”平台,可在微型反应器中同步完成山羊B细胞活化、抗体分泌检测与基因克隆,将单克隆抗体开发周期从数月缩短至数周。
在产业协同层面,重组抗体制备、阻断抗体开发与山羊抗体定制服务正形成互补共赢的生态体系。例如,在新型病毒中和抗体开发中,先通过山羊抗体定制服务获得广谱性结合抗体,再利用重组抗体制备技术进行人源化改造,最后通过阻断抗体开发优化其中和活性与药代动力学特性。这种多技术联用模式在埃博拉病毒与HIV疫苗研发中已取得显著成效。此外,抗体开发企业正通过整合三大技术构建“一站式”服务平台:客户提供靶点信息后,平台可自动匹配最佳技术路径(如选择山羊模型制备多克隆抗体、重组技术生产治疗性单抗、或阻断抗体设计功能性抑制剂),显著降低研发成本与风险。
尽管技术前景广阔,其大规模应用仍面临挑战。重组抗体制备的核心瓶颈在于表达系统的优化——不同宿主细胞(如CHO、HEK293)的糖基化修饰差异可能影响抗体功能,这需要建立更精细的细胞工程调控策略。阻断抗体开发的主要难点在于靶点可成药性评估,尤其是针对内在膜蛋白或动态构象变化的靶点,需开发更先进的体外模型(如类器官或膜蛋白纳米盘)进行验证。而山羊抗体定制服务的产业化难题在于动物伦理与成本控制,通过合成生物学手段构建体外免疫系统或将成为替代方案。
未来,重组抗体制备技术或向无细胞合成方向突破,利用体外转录翻译系统实现抗体的即时生产;阻断抗体开发将聚焦于动态可调式设计,通过光控或pH敏感型抗体实现治疗的时空精准调控;而山羊抗体定制服务可能与基因编辑结合,培育携带人类免疫基因的转基因山羊,直接产出全人源化抗体。这些突破不仅将推动抗体药物的升级迭代,还将为疾病诊断、生物制造与农业生物技术注入新动能,最终在人类健康与生命科学领域书写技术普惠的新篇章。

![LGP11831_1 [UPTS 2025] 追忆 学习笔记](https://s21.ax1x.com/2025/03/17/pEdQ0uF.md.png)