摘要总结
这篇文章是2025年1月发表在《Nature Communications》杂志上的一篇研究,标题为“Uncovering the whole genome silencers of human cells via Ss-STARR-seq”。这篇文章通过开发一种名为Ss-STARR-seq的高通量筛选技术,首次在全基因组范围内系统性鉴定了人类细胞中的沉默子(silencers),并揭示了其细胞特异性、功能冗余性以及与疾病相关的调控机制。这对于深入理解基因表达的精细调控、开发靶向沉默子的基因疗法,以及癌症等疾病的精准治疗具有重要意义。
研究背景
沉默子作为基因表达的“刹车元件”,与增强子共同调控基因活性。尽管其功能至关重要,但受限于技术瓶颈,全基因组范围内沉默子的系统性鉴定仍处于早期阶段。此前研究多依赖表观遗传标记(如H3K27me3)或小规模筛选方法,存在覆盖度低、假阳性率高的问题。ENCODE等计划虽推动了调控元件的注释,但沉默子的全面解析仍面临挑战。
研究分析
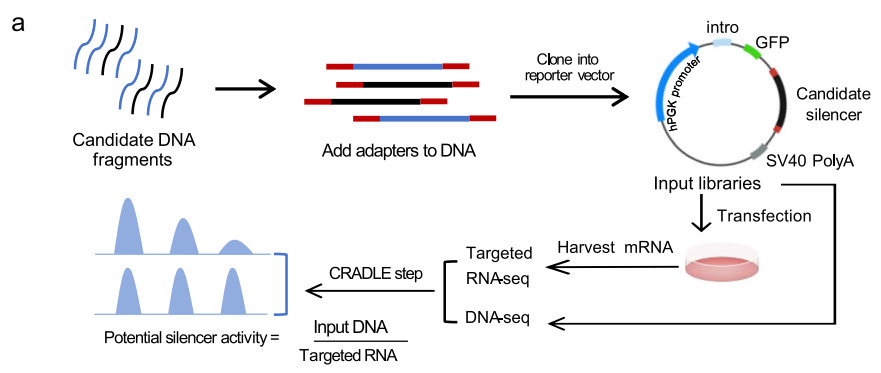
研究团队开发了Ss-STARR-seq技术,通过将基因组片段插入强启动子(hPCK)下游,结合转录组测序和CRADLE软件分析,直接定量沉默子的抑制活性。实验覆盖了人类基因组约91.4%的区域,平均测序深度达30.1×,并在K562、LNCaP和293T细胞中分别鉴定出134,171、137,753和125,307个沉默子。通过双荧光素酶报告系统、CRISPR敲除及功能富集分析,验证了沉默子的活性及其生物学效应。
研究结果
-
细胞特异性:83%-94%的沉默子具有细胞特异性,仅986个区域在三类细胞中共享。
-
表观特征:沉默子富集于异染色质区域,但与H3K27me3无显著关联,提示其活性不依赖特定组蛋白修饰。
-
功能机制:沉默子通过结合抑制性转录因子(如REST)及远程染色质互作调控基因表达;部分沉默子可转化为增强子或绝缘子,体现功能多样性。
-
疾病关联:靶向PTEN基因的沉默子敲除显著抑制癌细胞增殖,证实其作为治疗靶点的潜力。
文章亮点
-
技术突破:首次实现全基因组沉默子的高通量、无偏性筛选,覆盖度与准确性远超传统方法。
-
功能验证:通过多组学数据整合和实验验证,系统解析沉默子的调控网络及生物学意义。
-
临床价值:揭示沉默子在癌症中的关键作用,为开发基因疗法提供新方向。
局限与展望
- 研究仅在三个细胞系中进行,可能无法全面代表所有人类细胞类型。
- 尽管进行了验证实验,但仍可能存在假阳性或假阴性结果。
- Ss-STARR-seq方法的适用性和普适性需要在更多细胞类型和物种中进一步验证。
该研究为基因调控领域提供了全新工具与视角,未来结合单细胞技术与人工智能模型,有望全面解码沉默子在发育与疾病中的复杂角色。