今天给同学们分享一篇实验文章“Oral mucosal breaks trigger anti-citrullinated bacterial and human protein antibody responses in rheumatoid arthritis”,这篇文章发表在Sci Transl Med期刊上,影响因子为17.1。

结果解读:
口腔黏膜破裂会引发全身性炎症反应
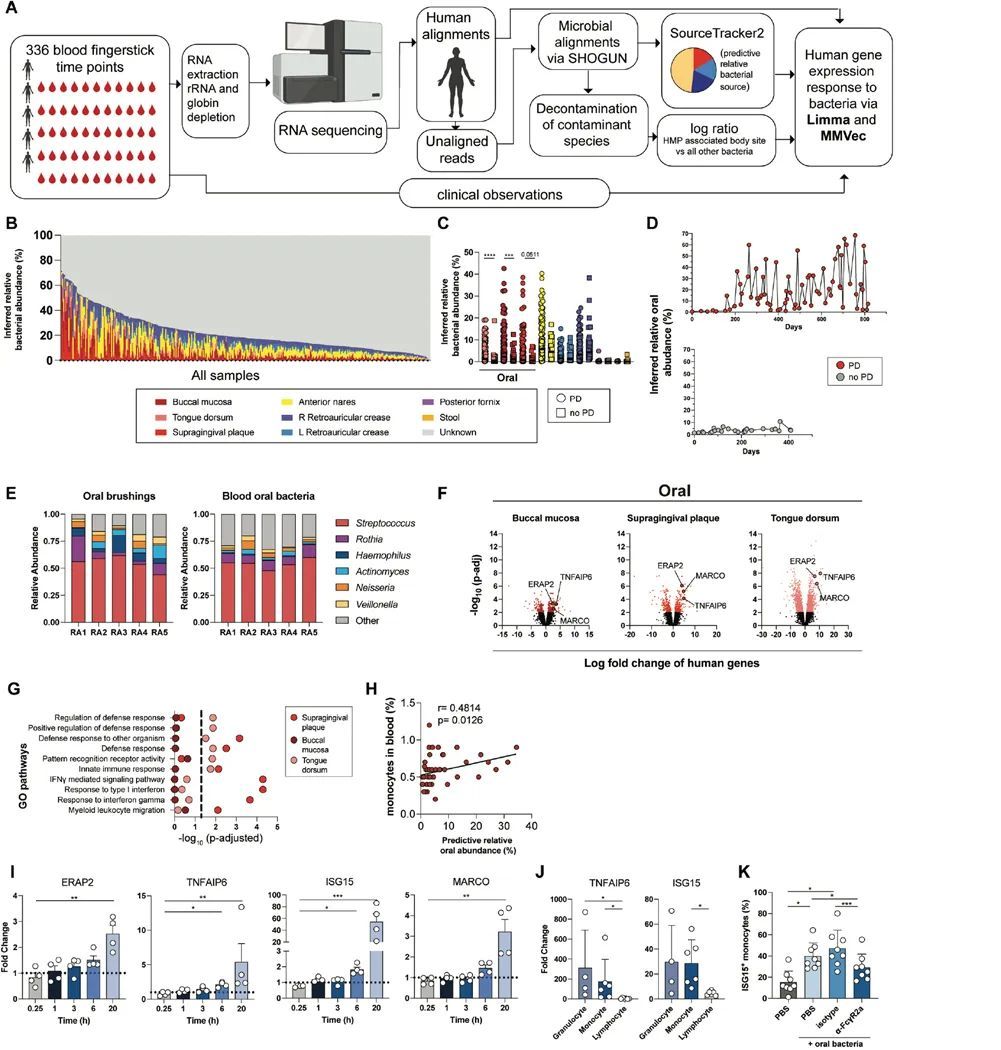
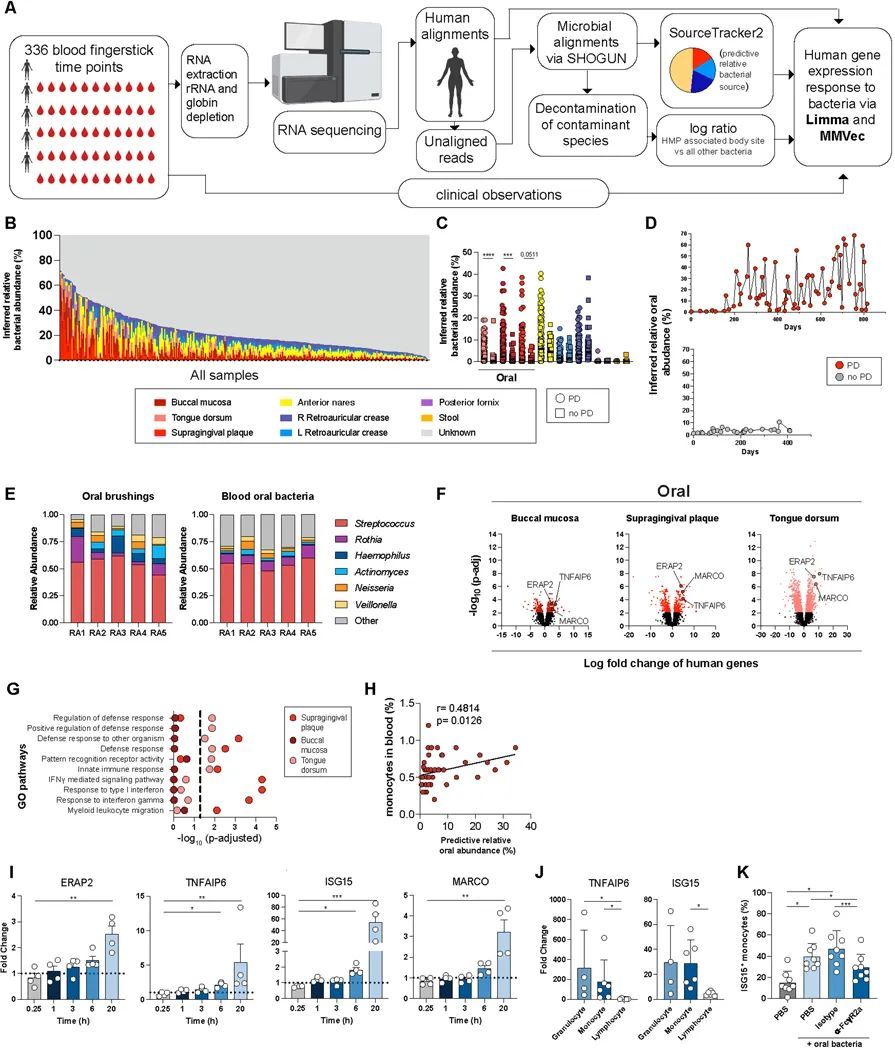
为了确定微生物组在患有牙周病的类风湿关节炎患者中的作用,作者对RA患者的血液样本进行了批量RNA测序(RNA-Seq)分析,其中包括患有牙周病和未患牙周病的患者,样本是通过每周一次的指尖采血,在一到四年的时间内获得的(洛克菲勒大学纵向队列,五名患者,每名患者平均n=67个时间点)。首先将RNA-Seq转录本与人类基因组(hg38)进行比对,以进行差异基因表达分析。然后将去除人类转录本的读取结果与微生物宏基因组数据库(Web of Life, WoL)进行比对(21),随后进行了一个体外去污染流程(22)(图1A-B)。为了确定血液中细菌的粘膜来源,作者使用SourceTracker2(23)推断了来自三个口腔粘膜部位(颊粘膜、牙龈上方菌斑和舌背)以及其他五个身体部位(粪便、阴道穹窿、鼻前庭、左右耳后襞)的细菌相对丰度,并使用人类微生物组计划(HMP)的相应身体部位样本进行了匹配(24)。由于HMP数据集没有使用转录组学,作者通过将该流程应用于公开可用的人类粪便样本的转录组数据集(25)来验证该方法。作者确定几乎所有预测的身体部位都是粪便。
在类风湿关节炎发作期间和口腔细菌血症反应中,炎症滑膜单核细胞基因在血液中富集
作者接下来的目标是确定牙周病患有关的口腔细菌血症是否会导致类风湿关节炎的急性发作。在作者之前的类风湿关节炎急性发作研究中(28),作者发现与基线相比,血液中的髓系相关途径在急性发作期间得到了丰富。使用图1中的同一纵向队列,作者比较了急性发作期间的基因表达与基线,并确定了牙周病患和非牙周病患的类风湿关节炎患者的差异表达基因(图2A)。作者将在牙周病关联和非牙周病关联的急性发作中具有一致折叠变化方向的基因分类为“共同发作基因”。相反,作者将在牙周病关联和非牙周病关联的急性发作中具有不一致折叠变化方向的基因分类为“牙周病特异性基因”(图2B)。牙周病特异性发作基因,而不是共同发作基因,富集了髓系白细胞迁移、免疫复合物清除和免疫球蛋白结合(图2C)。此外,只有牙周病特异性的爆发基因,而不是常见的爆发基因,富集了针对微生物和髓系免疫反应的抗体效应功能(图2C)。综上所述,这些数据表明:(i)对反复口腔细菌血症的免疫反应有助于类风湿关节炎的爆发,(ii)口腔细菌血症促进了患有牙周病的类风湿关节炎患者的抗体效应反应,以及(iii)对类风湿关节炎爆发的免疫特征是多变的,可能是由于不同的爆发触发因素。
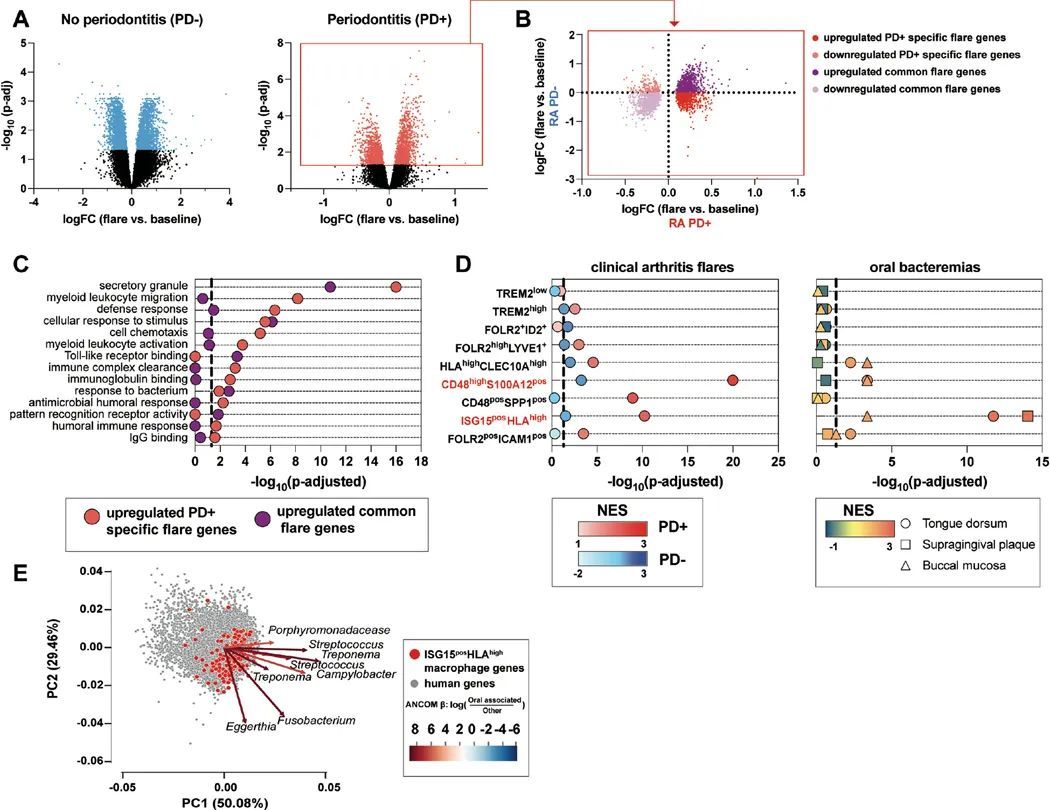
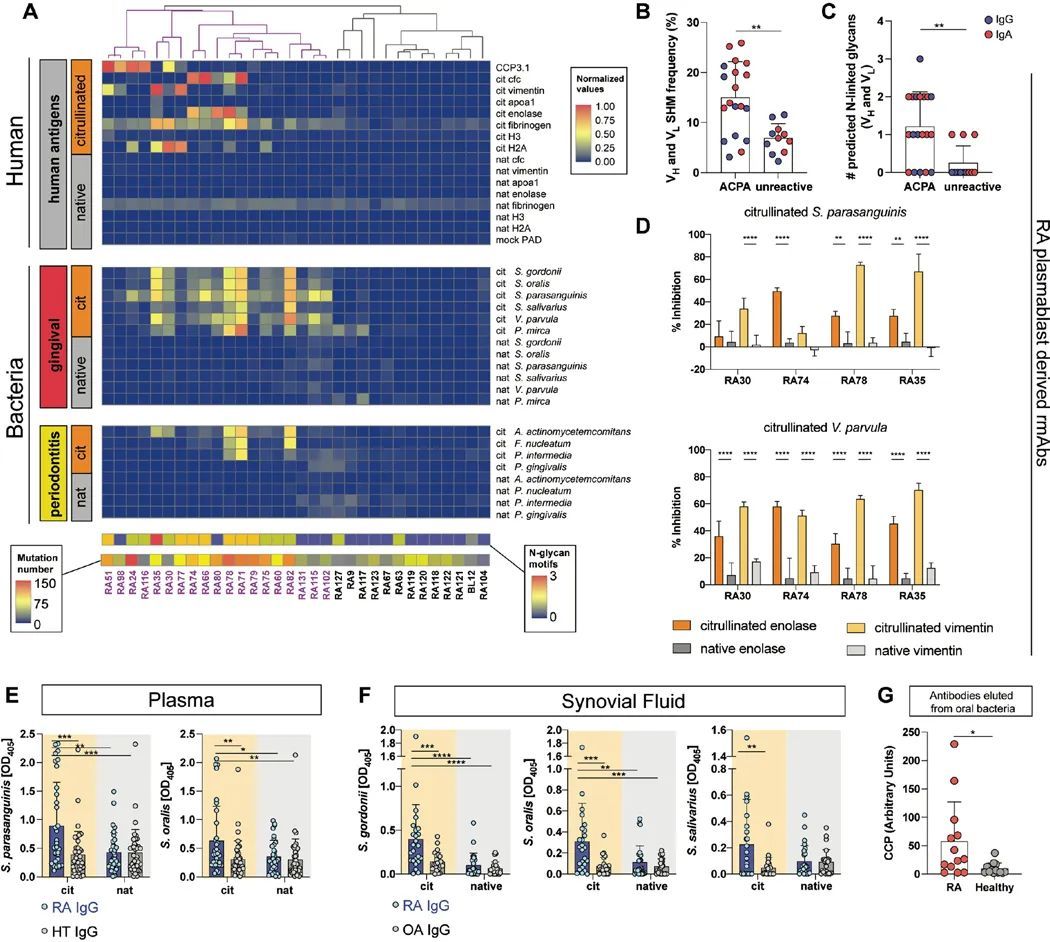
高度突变的RA抗体在体外结合了柠檬酸盐化的人类和细菌抗原
作者推断,如果患有牙周病的类风湿关节炎患者的发作与抗体效应功能有关,那么相对于没有类风湿关节炎的个体,类风湿关节炎患者可能会对口腔细菌产生额外的、更具特异性的反应。鉴于牙周病特别与抗环瓜氨酸蛋白抗体(ACPA)相关(31),作者假设ACPA可能与口腔细菌发生交叉反应。因此,作者对源自人类类风湿关节炎血浆细胞母细胞的单克隆抗体进行了筛选,针对一系列与口腔粘膜以及其他粘膜部位特征相关的人类蛋白和细菌裂解物。与人类瓜氨酸化自身抗原结合的类风湿关节炎单克隆抗体(ACPA单克隆抗体)与一系列体外瓜氨酸化细菌裂解物发生交叉反应,但与天然细菌裂解物或体外瓜氨酸化所用的PAD酶没有反应(图3A),表明它们也是抗瓜氨酸化细菌抗体(ACBA)。没有特异性针对瓜氨酸化人类抗原的类风湿关节炎抗体(非反应性单克隆抗体)对任何细菌裂解物的反应性很小(图3A)。值得注意的是,ACPA和不活化的mAb之间在B细胞受体(BCR)特征方面没有差异,如CDR3长度或亲水性(GRAVY分数)。相反,与不活化的mAb相比,ACPA mAb在重链和轻链(V H 和V L )基因的V区域中携带更多的体细胞高度突变(SHM)(图3B),后者与其他临床情况下的抗体反应具有相似的SHM百分比(32, 33)。此外,作者还调查了抗原结合片段(Fab)区域中N-连接糖基化基序(由一致序列N-X-S/T(34)定义),这些基序是促进与细菌凝集素结合的糖基化位点(19)。ACPA mAb含有预测的N-连接糖基化基序数量增加(图3C),与先前的报告一致(16, 35)。
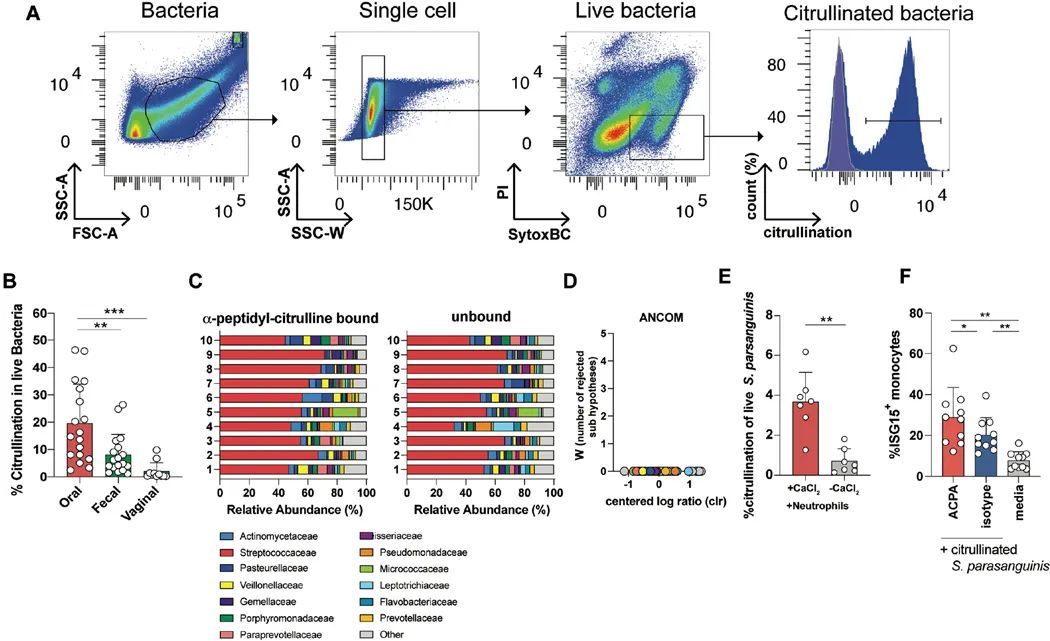
口腔细菌在体内高度脱氨酸化
作者接下来测试了各种黏膜部位的细菌在体内的脱氨酶作用程度。通过流式细胞术使用抗脱氨酶肽抗体分析了来自口腔、粪便和阴道的细菌的脱氨酶作用(图4A)。与粪便和阴道细菌相比,口腔细菌的脱氨酶作用比例最高(图4A,B)。
RA ACPA在体内结合到通过质谱检测到的脱氨基酸化细菌肽上
为了确定体内某些细菌的柠檬酸化表位,作者分析了一个包含30个人类唾液样本(43)的公开质谱数据集,这些样本来自牙周病患者、健康个体和龋齿患者,并鉴定出了五个含有去甲基化精氨酸的细菌源性肽段(图5A)。然后,作者测试了作者的21种抗胞核抗体(ACPA mAbs)库,以确定其是否与质谱检测到的这五个柠檬酸化细菌表位结合。其中八种ACPA mAbs与一个或多个柠檬酸化细菌表位强烈反应,表明人类唾液中存在的柠檬酸化细菌表位也被ACPA所识别(图5B)。
总结
总之,本文所述的研究结果表明,牙周病通过反复的粘膜破裂,导致复发的先天性和适应性免疫激活,这可能有助于RA的发病机制。作者的研究结果表明,未来需要进行研究,以确定改善口腔护理是否可以在RA的管理中提供治疗益处。